|
Контрольная работа: Альдегиды и кетоны: общие сведения и способы полученияКонтрольная работа: Альдегиды и кетоны: общие сведения и способы полученияВведениеАльдегиды и кетоны объединяют общим названием карбонилсодержащие или карбонильные соединения. В кетонах к карбонильной группе присоединены два углеводородных остатка, а в альдегидах один из них водород. В формальдегиде к карбонильной группе присоединены два атома водорода.
кетоны альдегиды формальдегид При назывании альдегидная группа может рассматриваться и как заместитель:
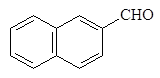
бензолкарб - циклогексан - 2-Нафталин- альдегид карбальдегид карбальдегид
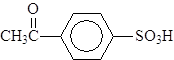
4-метаноилбензойная кислота 4-этаноилбензолсульфокислота (п-формилбензойная кислота) (п-ацетилбензолсульфокислота) За исключением газообразного формальдегида, низшие альдегиды и кетоны представляют собой подвижные жидкости. Температуры кипения альдегидов и кетонов ниже температур кипения спиртов с тем же числом атомов углерода, так как карбонильные соединения сами по себе водородных связей не образуют. Низшие альдегиды и кетоны растворимы в воде, видимо, за счет образования водородных связей:
Способы получения. Многие методы получения альдегидов и кетонов сходны, но существует и ряд особых способов, пригодных для синтеза только альдегидов или только кетонов. Окисление углеводородов. Простейший альдегид – формальдегид – можно получать окислением метана кислородом воздуха в присутствии медно-цинкового катализатора:
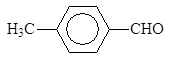
Окислением толуола может быть получен бензальдегид. Наиболее перспективно окисление кислородом воздуха в присутствии катализатора (например, V2O5):
Ацетофенон производится в промышленности каталитическим окислением этилбензола кислородом воздуха:
В качестве окислителя иногда используют серную кислоту. Так, обработка адамантана концентрированной серной кислотой при 75 оС в течение 5 ч с выходом 50-60% дает адамантанон:
адамантан фдамантанон Окисление этилена в присутствии хлоридов палладия (II) и меди (II) приводит к образованию ацетальдегида (Вакер-процесс):
При окислении этилена кислородом в присутствии триоксида молибдена и фосфорной кислоты сначала образуется окись этилена, но она немедленно изомеризуется в уксусный альдегид. Для уменьшения времени контакта, и предотвращения дальнейшего окисления ацетальдегида одновременно пропускают водяной пар.
Окисление спиртов Окисление спиртов обсуждалось в разделе 12.2.5. Окислением метанола получают формальдегид
Важный растворитель метилэтилкетон получают в промышленности окислением 2-бутанола.
В лабораторных же условиях в качестве окислителя используется бихромат калия или натрия в кислой среде. Окислителем в этом случае является хромовая кислота. Например, реакция
проходит по следующему механизму:
Альдегиды могут быть получены из первичных спиртов путем их окисления пиридинийхлорхроматом (ПХХ):
Упр.1. Напишите реакцию получения гептаналя из 1-гептанола. Упр.2. Напишите реакции, лежащие в основе промышленных методов получения (а) формальдегида, (б) ацетальдегида, (в) бензальдегида, (г) ацетона, (д) ацетофенона? Упр.3. Предложите схему получения формальдегида из СО и Н2. Гидроформилирование алкенов (Оксосинтез) При температуре от 30 до 250 оС и давлении 100-400 атм в присутствии дикобальтоктакарбонила алкены присоединяют водород и монооксид углерода с образованием альдегидов. Обычно получается смесь изомеров:
Пиролиз солей карбоновых кислот. При нагревании бариевых или кальциевых солей карбоновых кислот образуются кетоны. Именно так впервые был получен ацетон:
Из дикарбоновых кислот > С6 и выше получают циклические кетоны:
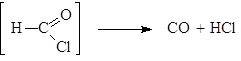
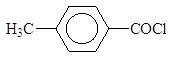
Упр.4. Напишите реакции получения (а) ацетона, (б) диэтилкетона и (в) циклопентанона пиролизом бариевых солей соответствующих кислот. Реакция Гаттермана-Коха. Арены формилируют смесью СО и HCl в присутствии хлоридов алюминия и меди (I):
п-толуиловый альдегид Эта реакция представляет собой вариант ацилирования, так как смесь CO и HCl можно представить себе как неустойчивый хлорангидрид муравьиной кислоты:
Роль CuCl состоит в первоначальном образовании комплекса с СО, что повышает его концентрацию в реакционной смеси. Фенолы и простые эфиры, а также нитробензол и все соединения с электро-ноакцепторными заместителями в реакцию Гаттермана-Коха не вступают. Упр.5. Напишите схемы получения по реакции Фриделя-Крафтса: (а) пропиофенона; (б) бутирофенона; (в) бензофенона. Упр.6. Напишите схемы получения ацетофенона: (а) окислением углеводо-рода, (б) окислением спирта, (в) гидролизом дигалогенуглеводорода, (г) ацилиро-ванием бензола. Восстановление производных карбоновых кислот Альдегиды можно получать восстановлением производных карбоновых кислот. Хлорангидриды кислот могут быть превращены в альдегиды восстановлением водородом в присутствии палладия, нанесенного на сульфат бария. Катализатор дезактивируют добавками хинолина с серой или тиомочевиной.
В современных методах в качестве восстановителей используют различные комплексные гидриды металлов. Одним из лучших восстановителей служит трис (трет-бутокси) гидроалюминат лития, образующийся при взаимодействии алюмогидрида лития с трет-бутиловым спиртом. Эфиры и нитрилы карбоновых кислот восстанавливаются в альдегиды с помощью диизобутилалюминийгидрида.
LiAlH(t-BuО) 3
Трис(трет-бутокси) гидроалюминат лития Диизобутилалюминийгидрид
Эфиры и нитрилы карбоновых кислот восстанавливаются в альдегиды с помощью диизобутилалюминийгидрида.
(DIBAL-H)
Литийдиалкилкупратный метод получения кетонов При действии литийдиалкилкупрата на хлорангидриды карбоновых кислот в эфире при охлаждении образуются кетоны:
Упр.7. Напишите реакции, приводящие к следующим превращениям: (а) бензол ® бромбензол ® фенилмагнийбромид ® бензиловый спирт ® бензальдегид; (б) толуол ® бензойная кислота ® бензоилхлорид ® бензальдегид; (в) этилбромид ® 1-бутин ® 2-бутанон; (г) 2-бутин ® 2-бутанон; (д) 1-фенилэтанол ® ацетофенон. (е) бензоилхлорид ® ацетофенон; (ж) бензойная кислота ® ацетофенон; (з) бензилбромид ® С6Н5СН2СN ® 1-фенил-2-бутанон; (и) С6Н5СН2СN ® 2-фенилэтаналь: (з) метилкапронат ® гексаналью В результате взаимодействия альдегидов и кетонов с углеродными нуклеофила-ми образуются новые связи С¾С. Такими нуклеофилами служат реактивы Гриньяра, литийорганические соединения, ацетилениды и циановодородная кислота.
А. Присоединение реактивов Гриньяра. Особая ценность реактивов Гриньяра заключается в их способности создавать новые связи С¾С. Разница в электроотрицательности между углеродом и магнием (2,5 - 1,2 = 1,3), обусловливает полярность связи между этими атомами и наличие частичного отрицательного заряда на атоме углерода и частичного положительно-го заряда на атоме магния. В реакциях реактивы Гриньяра ведут себя как карбанионы. Карбанионы являются хорошими нуклеофилами и легко присоединяются к карбонильной группе. Магнийорганические соединения вступают в реакции нуклеофильного присоединения к альдегидам и кетонам с образованием алкоксидов, гидролизующихся в спирты: Присоединение к формальдегиду приводит к образованию первичных спиртов.
(17) Другие альдегиды дают вторичные спирты:
1-Циклогексилэтанол Из кетонов получают третичные спирты:
2-Фенил-2-пропанол
Б. Присоединение литийорганических соединений. Литийорганические соединения более реакционноспособны, чем магнийлрганичес-кие и обеспечивают больший выход целевого продукта. Онако с ними можно работать только в атмосфере инертного газа. Ниже приводится пример использования литийорганического соединения для получения стерически затрудненного третичного спирта.
Фениллитий 3,3-Диметил-2-бутанон 3,3-Диметил-2-феил-2-бутанол В. Присоединение ацетиленидов металлов Этинид-анион также является нуклеофилом. Образующиеся при этом спирты содержат две функциональные группы, каждая из которых может быть далее модифицирована.
1-этинилциклогексанол Гидратация полученного алкинола приводит к образованию a-гидроксикетона, а гидроборирование-окисление - b-гидроксиальдегида.
1-ацетилциклогексанол (a-гидроксикетон)
2-(1-гидроксициклогексил) этаналь (b-гидроксикетон) |
|
|
| 17.06.2012 |
| Большое обновление Большой Научной Библиотеки |
| 12.06.2012 |
| Конкурс в самом разгаре не пропустите Новости |
| 08.06.2012 |
| Мы проводим опрос, а также небольшой конкурс |
| 05.06.2012 |
| Сена дизайна и структуры сайта научной библиотеки |
| 04.06.2012 |
| Переезд на новый хостинг |
| 30.05.2012 |
| Работа над улучшением структуры сайта научной библиотеки |
| 27.05.2012 |
| Работа над новым дизайном сайта библиотеки |


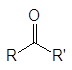
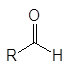
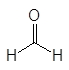
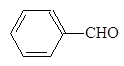
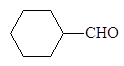

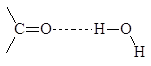
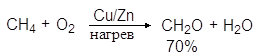 (1)
(1) 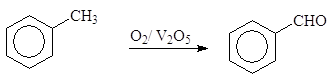 (2)
(2) 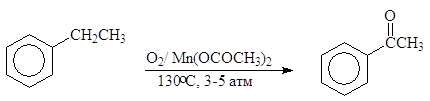 (3)
(3) 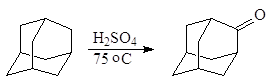 (4)
(4) 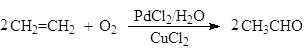 (5)
(5) 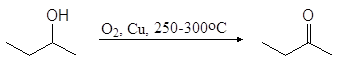 (8)
(8) 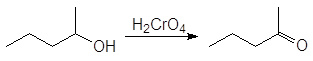 (9)
(9) 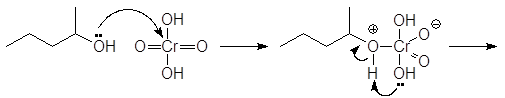 (М 1)
(М 1) 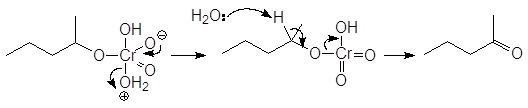
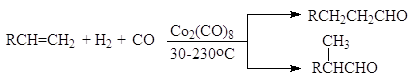 (10)
(10) 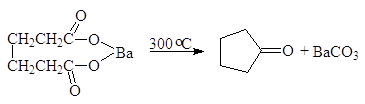 (12)
(12) 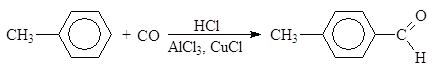 (13)
(13) 
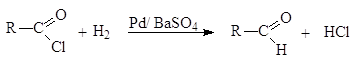
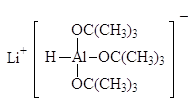
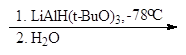
 (14)
(14) 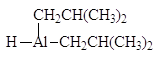
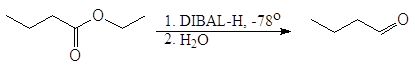 (15)
(15) 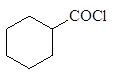
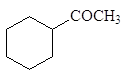 (16)
(16) 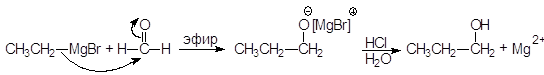
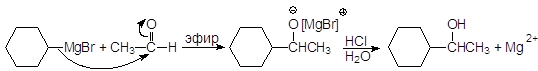 (18)
(18) 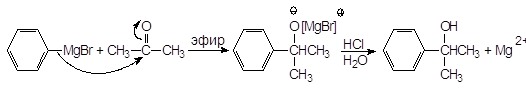
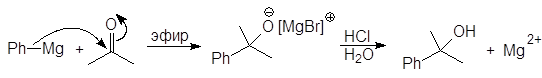 (19)
(19) 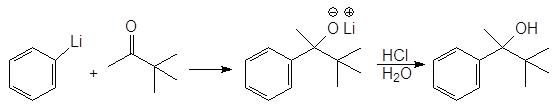 (20)
(20) 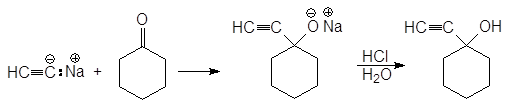 (21)
(21) 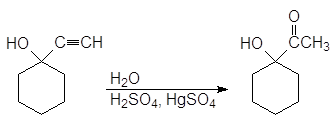 (22)
(22) 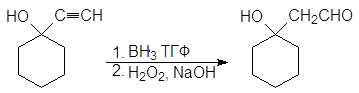 (23)
(23)