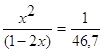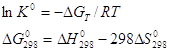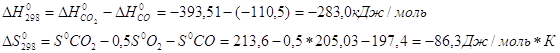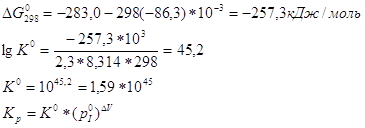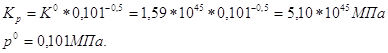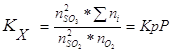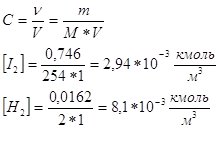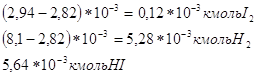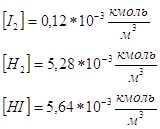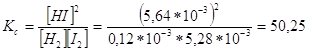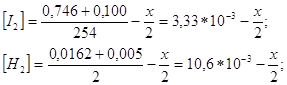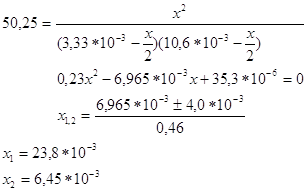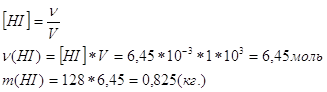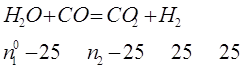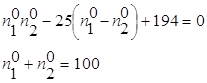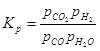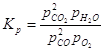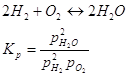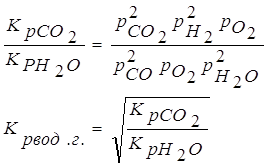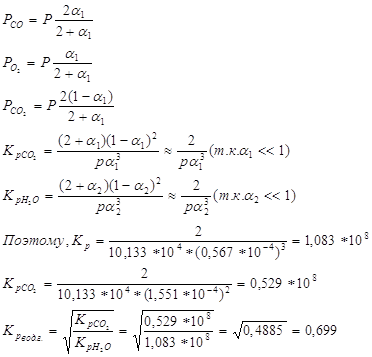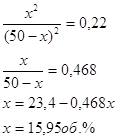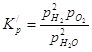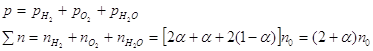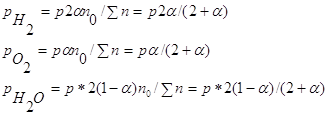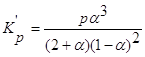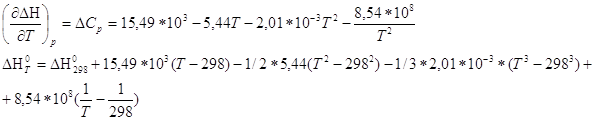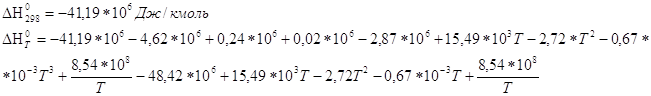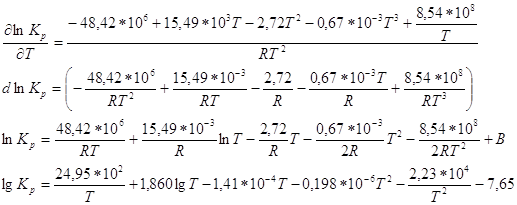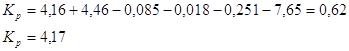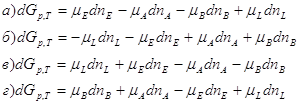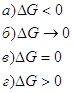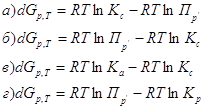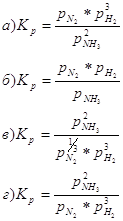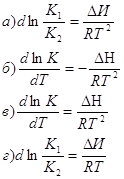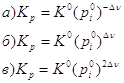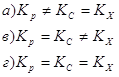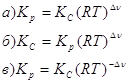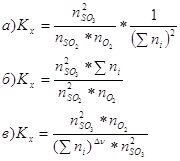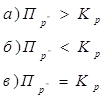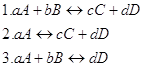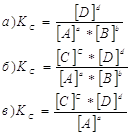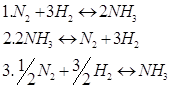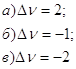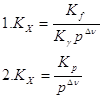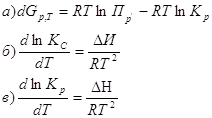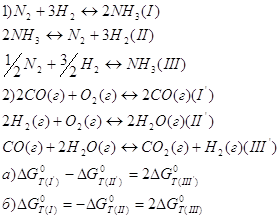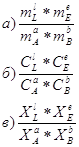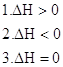|
Контрольная работа: Гомогенное химическое равновесиеКонтрольная работа: Гомогенное химическое равновесиеГомогенное химическое равновесие Контрольная работа Вариант№1 1.
Рассчитайте
сродство (-ΔrGt) железа к кислороду воздуха, Po2=2,0266*104Па при 1000К, если константа
равновесия реакции 2Fe+ O2 2.
Константа
равновесия реакции H2+I2 3. Вычислите при температуре 298К константу равновесия реакции CO+0,5O2=CO2 по стандартной энергии Гиббса. Критерии оценивания Данная к/р оценивается в 45 баллов. №1-10 баллов, №2-15 баллов, №3-20 баллов. Наиболее характерные ошибки: - использование неправильных размерностей величин; - ошибки при выводе ур-ния Кс реакции; - неправильное решение квадратного ур-ния и использование его отрицательных корней (для нахождения кол-ва моль прореагировавшего в-ва); - ошибки при счёте; - использование неверных справочных значений(необходимо использовать величины, выраженные в Дж/моль, Дж/моль*К или кДж/моль); - следует учесть, что энтальпия реакции образования простых веществ равна 0; - для расчета стандартной энергии Гиббса необходимо значение энтропии реакции перевести в кДж/моль; - если реакция проводится в стандартных условиях, то необходимо использовать PO=0,101Мпа=101,3кПа. Решение задач №1. 2Fe+
O2 ΔG=-RTlnKp+RTПі(Pνіі исх.) ΔG=-8,314*1000ln(2,450*1020)+8,314*1000ln(2,0266*104)= -390324-82447=-472,77 кДж/моль. Ответ. (-ΔrGt)=472,77 кДж/моль. №2 2HI исх. 1моль 0 0 Реак. 2х х х Равн. 1-2х х х Кс= 46,7x2=1-4x+4x2 42,7x2+4x-1=0 D=186,8 x1= 2x=0,227 (моль) Ответ. Разложилось 0,227 моль HI. №3
Все
необходимые значения станд.
ΔV-приращение числа молей во время реакции. Для реакции CO+0,5O2=CO2 ΔV=1-(1+0,5)= -0,5
Ответ. Индивидуальное задание Вариант№5 1. По значениям изобарных потенциалов в справочнике [M.] определите константу равновесия при температуре 298К для реакции:
2. При окислении SO2 в SO3 в газовой фазе установилось хим. равновесие:
Как будет влиять на это равновесие увеличение давления и добавление азота, не участвующего в реакции? Ответ дать на основании термодинамич. соотнош. И пользуясь принципом Ле-Шателье. 3. Если нагреть 0,746 кг йода и 0,0162 кг водорода в закрытом сосуде ёмкостью 1 м3 до 693К, то при достижении равновесия образуется 0,721 кг йодистого водорода. Сколько йодистого водорода получится, если к исходной смеси добавить 0,1 кг йода и 0,005 кг водорода? 4.
Процесс получения водяного газа идёт по ур-нию 5. При Т=1396К и Р=1,0133*105 н/м2 степень диссоциации водяного пара на водород и кислород равна 0,567*10-4 , а степень диссоциации двуокиси углерода на окись углерода и кислород при тех же условиях -1,551*10-4. Определить на основании этих данных состав водяного газа, образующегося при указанной температуре из равных объёмов окиси углерода и водяного пара. 6.
При температуре 1500К и давлении 0,1013 МПа степень диссоциации водяного пара 7. Для
реакции Справочник [M.] –краткий справочник физико-химических величин. под ред. К.П.Мищенко и А.А.Равдия, М.,Госхимиздат, 1967г. Критерии оценивания Данное индивидуальное задание оценивается в 110 баллов. №1,2 -10 баллов; №4,6 -15 баллов; №3,5,7 -20 баллов; Наиболее характерные ошибки: - использование неверных справочных данных; - ошибки при выводе ур-ния Кс и Кр для исследованной реакции; - ошибки при вычислении равновесной концентрации вещества; - использование неверных корней квадратного уравнения(полученное значение корней квадратного уравнения необходимо сопоставлять с условием задачи, чтобы не получить отрицательные значения концентраций); - ошибки при счёте; - при расчёте по уравнению реакции необходимо учитывать коэффициенты, стоящие перед веществом; - необходимо все единицы измерения выражать в СИ (как например, парциальное давление газов в н/м2); -
нужно использовать значения температуры процесса в К для расчёта - ошибки могут быть при неверной трактовке уравнения Менделеева-Клапейрона (следует учесть число моль-n); -следует отличать равновесные и неравновесные процессы и учитывать правильность их написания; - справочные данные должны соответствовать необходимому в-ву, которое указано в условии задачи; - ошибки также возникают при переводе моль в кмоль, кал в Дж. Решение задач №1 В справочнике
физико-химических величин [M.],
находим значения
Используя уравнение:
Δn- изменение числа молей газообразного конечного и начального продуктов реакции. Кр и парц. давления выражены в н/м2. и ур-ние
Ответ.lg Kp=55,87. №2 В данной реакции ΔV=2-3=-1, поэтому выражение для Кх примет вид:
Из
уравнения видно, что с увеличением давления р увеличивается константа
равновесия Кх, поскольку Кр не зависит от давления. Увеличение Кх произойдёт за
счёт увеличения числителя и за счёт уменьшения знаменателя. При отсутствии
инертной примеси азота Принципа смещения равновесия Ле Шателье приводит с к следующим качественным выводам. Т.к. реакция образования SO3 из SO2 и O2 идёт с уменьшением объёма, то при увеличении давления, т.е. при сжатии реагирующей смеси, процессом ослабляющим сжатие, будет процесс, приводящий к уменьшению числа молекул в реагирующей смеси. Таким образом, при увеличении давлении реакция сдвинется слева на право и выход SO3 возрастёт. Увеличение содержания азота при постоянном общем давлении ведёт к разбавлению реагирующей смеси, что равноценно уменьшению давления при отсутствии азота, т.е. приведёт к сдвигу равновесия справа налево, выход то равноценно уменьшению давления при отсутствии азота, ведёт к разбавлению реагирующей смесию числа молекул в реагирующей с SO3 уменьшится. №3 Реакция протекает по уравнению: H2+I2 Константа равновесия этой реакции может быть выражена уравнением:
Для определения величины константы равновесия необходимо определить состав равновесной газовой смеси. H2 и I2 реагируют с образованием HI, то в равновесной смеси исходное кол-во будет меньше, чем в исходной. Исходная концентрация H2 и I2 :
Конц. получ. HI в равновесной смеси:
Реакция протекает при постоянном давлении, тогда: H2+I2 1кмоль 1кмоль 2кмоль
(2,82кмоль 2,82 кмоль 5,64 кмоль)*10-3 След., в равновесной смеси останется:
Данные вещества находятся в V=1м3, поэтому
Используя полученные концентрации, определим константу равновесия:
При добавлении к исх. смеси 0,100кг I2 и 0,005 кг H2 установ. равнов., но Кс не изменится. Обозначим новую равновесную конц. [HI]=x, тогда равнов. конц. [I2 ] и [H2 ] будут равны:
Получим уравнение:
Х1 не имеет
физ.смысла, т.к.конц. H2 и I2 будут иметь отрицательные значения.След.,
Ответ. №4 Напишем содержание компонентов в процентах в равновесной смеси:
Для
рассматриваемой реакции Подставим содержание веществ (в молях) в выражение для константы равновесия:
откуда
т.к. в ходе реакции число
молей в системе не меняется. Исключая из этих уравнений
Его решение даёт два
действительных корня: №5 Реакция образования водяного пара протекает по уравнению:
Константа равновесия равна:
Диссоциация двуокиси углерода: 2CO+O2=2CO2
Диссоциация водяного пара:
Равновесная концентрация кислорода в данных реакциях одинакова, тогда:
Выразим константу равновесия реакции диссоциации воды и двуокиси углерода через общее давление и степень диссоциации:
По условию начальные об. конц. воды и укиси углерода равны 50об.%,
обозначим конц. образ. Н2 и СО2 в сост. равновесия x об.%, получим: Состав водяного газа имеет вид:
Ответ. 15,95 об.% №6 Напишем равновесные числа молей реагентов, выраженные через степень
диссоциации
n0 –начальное количество (число молей) водяного пара. Константа равновесия этой реакции будет выражаться уравнением:
Выразим парциальные давления реагентов через общее давление Р, общее
число молей
Парциальные давления реагентов вычисляются по уравнению
Таким образом, Т.к.
Для обратной реакции, т.е для реакции горения водорода при 1500К, получим:
Ответ. №7 Зависимость теплового эффекта от температуры опред. законом Кирхгоффа:
По справочнику [M] находим зависимость теплоёмкости веществ от температуры
По уравнению находим Кр при 600К:
Ответ. Тест В вопросах 1-10 необходимо выбрать правильный ответ (он может быть только один). 1. При наступлении состояния химического равновесия протекают следующие процессы: а) число молекул веществ, составляющих химическую систему увеличивается во времени при неизменных внешних условиях; б) число молекул веществ, составляющих химическую систему остаётся постоянным во времени при неизменных внешних условиях; в) число молекул веществ, составляющих химическую систему, уменьшается во времени при неизменных внешних условиях. 2.
Для реакции:
3. Для состояния химического равновесия характерно:
4. Уравнение изотермы химической реакции имеет вид:
5.
Для реакции: Константа равновесия, выраженная через парциальные давления газов, записывается так:
6. Какое из выражений соответствует уравнению изобары химической реакции:
7. Стандартная константа равновесия связана с константой равновесия Кр соотношением:
8. Для реакции в газовой фазе, протекающей без изменения числа молей (Δν=0) характерно:
9. Связь между Кр и Кс химической реакции выражается уравнением:
10. В
общем виде Кх для реакции:
Правильные ответы:
Каждый правильный ответ на один вопрос оценивается в 1 балл. В результате, ответив на 10 вопросов, можно получить 10 баллов.
В вопросах 11-20 необходимо установить соответствие. (например 1б, 2а,3г)-верный ответ может быть только один. 11.
Из уравнения изотермы химической реакции 1.ΔG<0 2. ΔG=0 3. ΔG>0
12. Для данных реакций укажите соответствующие им константы равновесия Кс:
13. Определите зависимость между значением энергии Гиббса реакции и характером протекающего процесса: 1.ΔG<0 а) реакция достигла состояния 2. ΔG=0 равновесия; 3. ΔG>0 б) процесс необратимый самопроизвольный; в) процесс необратимый несамопроизвольный 14. Определите изменение числа молей (Δν) для следующих реакций:
1.Δν>0 а) Кх уменьшается 2.Δν<0 б) Кх не изменяется 3.Δν=0 в) Кх увеличивается 16. Определите Кх для реакции в идеальной и реальной газовой смеси:
а) идеальная газовая смесь б) реальная газовая смесь 17. Из приведённых уравнений выберите то, которое является изотермой, изохорой, изобарой химической реакции: 1. уравнение изохоры химической реакции 2. уравнение изобары химической реакции 3. уравнение изотермы 18. Для данных уравнений реакции в смеси идеальных газов определите соотношение между значениями стандартной энергией Гиббса:
19. Укажите верное выражение для Кх, Кс и Кm при рассмотрении равновесия химической реакции в идеальном растворе:
20. Установите, как будет влиять тепловой эффект реакции на константу и состояние равновесия химической реакции:
а) константа равновесия не изменится, и состояние равновесия останется неизменным; б) равновесие сдвинется в сторону исходных веществ; в) константа равновесия увеличится, и равновесие сдвинется вправо. Правильные ответы
Каждый правильный ответ на 1 вопрос оценивается в 1 балл. Ответив на 10 вопросов можно получить 10 баллов. Если в ответе одна половина соответствия букв и цифр верна, а другая нет, то такой ответ не учитывается и оценивается в 0 баллов. В вопросах 21-30 пропущено слово-ответ, его необходимо записать (ввести) в правильном числе и падеже. 21. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
| 17.06.2012 |
| Большое обновление Большой Научной Библиотеки |
| 12.06.2012 |
| Конкурс в самом разгаре не пропустите Новости |
| 08.06.2012 |
| Мы проводим опрос, а также небольшой конкурс |
| 05.06.2012 |
| Сена дизайна и структуры сайта научной библиотеки |
| 04.06.2012 |
| Переезд на новый хостинг |
| 30.05.2012 |
| Работа над улучшением структуры сайта научной библиотеки |
| 27.05.2012 |
| Работа над новым дизайном сайта библиотеки |