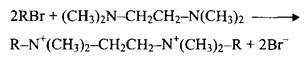|
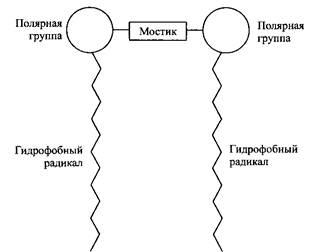
Контрольная работа: Поверхностно-активные веществаКонтрольная работа: Поверхностно-активные веществаСодержание 1. Поверхностно-активные вещества с необычной структурой: димерные ПАВ 2. Поверхностно-активные вещества с разрушаемыми связями: привлекательность с экологической и других точек зрения 1. Поверхностно-активные вещества с необычной структурой: димерные ПАВ Молекулу димерного поверхностно-активного вещества можно представить как две дифильные молекулы соединенные мостиком. Структура таких ПАВ в общем виде представлена на рис. 1. Димерные ПАВ называют также ПАВ-близнецы или бис-ПАВ. Мостик может быть гидрофильным или гидрофобным, жестким или гибким. Он связывает две молекулы по полярным группам или вблизи этих групп. Связывание двух молекул по гидрофобным частям ведет к образованию так называемых болаподобных ПАВ. Физико-химические свойства таких веществ полностью отличаются от физико-химических свойств димерных ПАВ. Большинство димерных ПАВ состоят из двух идентичных частей. Синтезированы также несимметричные димерные ПАВ, различающиеся либо длиной гидрофобной цепи, либо типом полярных групп, либо и тем и другим.
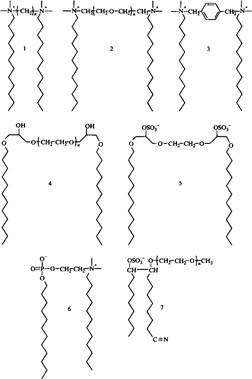
Рис. 1. Схематическая структура димерных ПАВ В последние годы из индивидуальных ПАВ синтезированы «олигомеры высшего порядка»: трис-ПАВ, тетра-ПАВ и т.д. Однако пока мало что известно о свойствах и возможных применениях таких ПАВ. Димерные ПАВ до сих пор в больших масштабах на рынке не представлены, но они привлекают значительное внимание как исследователей, так и технологов в промышленности. Некоторые типы таких ПАВ получают простым синтезом из доступного сырья, в частности это относится к симметричным катионным ПАВ. На рис. 2 представлены некоторые примеры димерных ПАВ. Соединения 1-3 — катионные ПАВ, различающиеся длиной мостика, связывающего ионные группы. В соединении 1 мостик гидрофобный и гибкий; в соединении 2 — гидрофильный и гибкий, а в соединении 3 гидрофобный и жесткий. Соединения 4 и 5 имеют похожую структуру молекул, но соединение 4 типичное неионное димерное ПАВ, а соединение 5 — анионное. Соединения 6 и 7 примеры гетеродимерных ПАВ. Синтез димерных ПАВ Катионные димерные ПАВ, например соединения 1-3 на рис. 2, обычно получают по реакции алкилдиметиламинов с б,щ-дигалогенпроизводными. Ди-бром-соединения обладают наибольшей реакционной способностью и обычно используются для синтеза в лабораторных условиях, дихлор-производные предпочтительнее в условиях крупномасштабного синтеза:
где R — алкильный радикал обычной для ПАВ длины, например С12Н25. Группа X — алкилен, если нужен гидрофобный гибкий мостик; СН2СНСН2 или СН2-СН2 — чтобы получить гидрофильный гибкий мостик; наконец, СН2 - ф - СН2, если мостик должен быть гидрофобным и жестким. В специальном, но очень важном случае, если X в представленной выше реакции должен быть группой СН2СН2, соединения типа На1СН2СН2На1 недостаточно реакционноспособны. В этом случае приходится использовать другой путь синтеза:
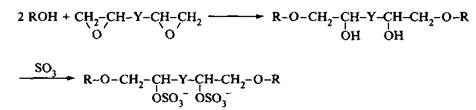
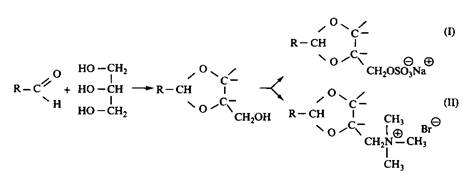
Анионные и неионные димерные ПАВ обычно получают путем раскрытия циклов бисэпоксидов, в результате этой реакции в качестве промежуточного продукта получается бисгидроксиэфир. Ниже приведена реакция синтеза димерного ПАВ, в котором полярными группами служат сульфат-группы:
Рис. 2. Структуры димерных ПАВ: соединения 1-3 — катионные ПАВ, различающиеся типом мостика; соединения 4 и 5 соответственно неионное и анионное ПАВ с одинаковыми структурами основной цепи; соединения 6 и 7 — гетеродимерные ПАВ, содержащие разные полярные группы
где R алкильная цепь обычных ПАВ, Y ОСН2СН2О. Ниже приведена реакция синтеза гетеродимерного ПАВ:
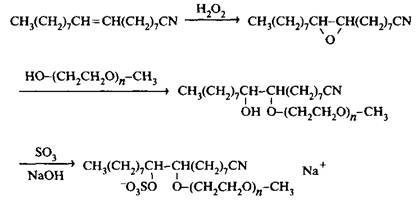
Мицеллобразование димерных ПАВ и поведение на границе раздела вода-воздух. Поразительное свойством димерных ПАВ состоит в том, что мицеллобразование в их растворах начинается при концентрациях на порядок ниже, чем для соответствующих «мономерных» ПАВ. Низкое значение KKM — важнейшее свойство, означающее, что димерные ПАВ очень эффективны при солюбилизации неполярных соединений. Эффективность снижения поверхностного натяжения, выраженная величиной С20, также выше для димерных ПАВ. Поверхностное натяжение для растворов таких ПАВ в точке KKM ниже, чем для растворов «мономерных» ПАВ. На рис. 3 в качестве примера приведены изотермы поверхностного натяжения катионного димерного ПАВ и соответствующего мономерного соединения. Интересно сравнить свойства катионного димерного ПАВ, которое содержит два гидрофобных радикала и две гидрофильные группы, с обычным катионным ПАВ, содержащим два таких же гидрофобных радикала и одну полярную группу. KKM бромида ди-децилдиметиламмония равна 1.8 · IO3 М, а у более длинного гомолога бромида дидодециламмония — 1.7 · IO^ М. Как следует из рис. 3, KKM димерного ПАВ с додециловыми гидрофобными радикалами очень низкая. Весьма важным свойством, имеющим практическое значение для неравновесных процессов типа эмульгирования и пенообразования, является динамическое поверхностное натяжение. Оно служит мерой того, насколько быстро поверхностно-активное вещество снижает поверхностное натяжение от значений для чистой воды до значений 30 мН/м. Обнаружено, что тип мостика заметно влияет на динамическое поверхностное натяжение димерных ПАВ: чем длиннее мостик и чем он более гибкий, тем меньше время снижения поверхностного натяжения.
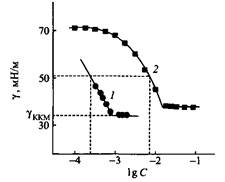
Рис. 3. Зависимость поверхностного натяжения от IgC для димерного ПАВ Ci2H2SN2 -3 - N2Ci2H2S2+ 2Br и мономерного ПАВ Cj2H25N3 + Br" Значения KKM димерных ПАВ с гибкими мостиками, независимо от того гидрофильные они или гидрофобные, гораздо ниже, чем у соответствующих ПАВ с жесткими мостиками. Этот факт можно объяснить тем, что соединения первого типа легче упаковываются на поверхности вода - воздух. Опубликованы данные о том, что KKM димерных ПАВ более чем в 80 раз ниже KKM мономерных ПАВ с одинаковыми гидрофобными радикалами и полярными группами. Значения KKM димерных ПАВ слабо зависят от полярности мостика, но они зависят от его длины. На рис. 4 представлены зависимости KKM от длины гидрофобных мостиков для трех типов димерных ПАВ-близнецов. Для всех этих ПАВ максимальное значение KKM наблюдается при одной и той же длине мостиков. Максимум связан с изменениями кон-формации мостика, которая влияет на гидратацию полярной группы и на ориентацию алкильных цепей. Если мостик становится достаточно длинным, он может изгибаться, так чтобы его средняя часть оставалась внутри мицеллы, что повышает гидрофобность ПАВ. Если димерные ПАВ содержат гидрофильный мостик, например олиго, KKM монотонно растет с увеличением его длины. Площадь, которую занимает молекула ПАВ на поверхности вода - воздух, можно оценить с помощью уравнения Гиббса из наклона зависимости поверхностного натяжения г от логарифма концентрации InC Уравнение Гиббса можно использовать для изучения упаковки ПАВ на поверхности.
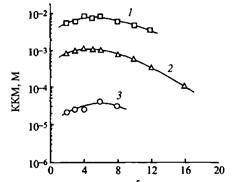
Рис. 4. Зависимость KKM от числа метиленовых групп в мостике для трех типов катионных димерных ПАВ: 1 — Ci0H2IN2-5-N2C1OH2I2Br-; 2 — Ci2H25N2-5-N2Ci2H2S2+ 2ВГ; 3 — Ci6H33N-5- N2Ci6H332* 2ВГ На рис. 5 показано изменение площади, приходящейся на молекулу ПАВ, в зависимости от длины мостика для ряда катионных димерных ПАВ. Из рисунка видно, что при длине мостика в 10-12 атомов углерода наблюдается максимальное значение площади а на молекулу. Такая зависимость объясняется изменением положения гидрофобного мостика. При длине менее 10 атомов углерода он располагается на поверхности почти плоско, занимая все большую и большую площадь с ростом числа метиленовых групп. Если мостик содержит более 12 атомов углерода, его цепочка начинает складываться, образуя петли, которые выталкиваются в воздух. Это объяснение аналогично тому, которое было дано выше для зависимости KKM от длины цепи гидрофобного мостика.
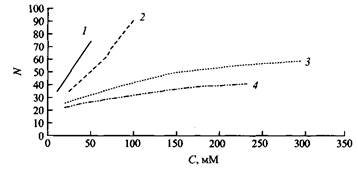
Рис. 5. Зависимость площади а на молекулу ПАВ на границе вода - воздух от числа метиленовых групп в мостике для ряда димерных ПАВ Ci2H25N2 - 5 - N2C й23252+ 2ВГ Форма мицелл димерных ПАВ и ее влияние на реологические свойства растворов. Катионные димерные ПАВ при низких концентрациях, как и соответствующие обычные катионные ПАВ, образуют сферические мицеллы. Число агрегации для ПАВ с 12 атомами углерода в гидрофобных «хвостах» изменяется от 40 до 25 при изменении длины мостика от двух до десяти метиленовых групп. ПАВ с короткими мостиками уже при очень низких концентрациях обнаруживают рост чисел агрегации с переходом от сферических мицелл к удлиненным мицеллам. Тогда как для ПАВ с более длинными мостиками характерно незначительное увеличение мицелл с ростом концентрации. В этом отношении они ведут себя подобно соответствующим «мономерным» ПАВ. Зависимости чисел агрегации димерных ПАВ с мостиками разной длины от концентрации показаны на рис. 6. Объяснить их можно следующим образом. Если мостик содержит 4 атома углерода или менее, расстояние между полярными группами становится меньше, чем расстояние между полярными группами в мицеллах обычных ПАВ, что и определяет разницу в упаковке молекул в мицеллах. Можно сказать, что димерные ПАВ упаковываются в мицеллу так, как будто бы их полярные группы меньше по размеру, чем на самом деле. Этим обусловлено стремление таких ПАВ к образованию стержнеоб-разных мицелл. Из геометрических соображений следует, что ПАВ с небольшими полярными группами преимущественно самоорганизуются в удлиненные структуры. Когда длина мостика становится равной или даже больше обычного расстояния между полярными группами катионных ПАВ в мицеллах, увеличение размера мицелл с концентрацией становится таким же, как и в случае «мономерных» ПАВ.
Рис. 6. Зависимость мицеллярных чисел агрегации N от концентрации С катионных димерных ПАВ, содержащих гидрофобную группу С12Н25 и мостики разной длины. Длина мостика: три метиленовые группы, четыре метиленовые группы, пять метиленовых групп. Для сравнения представлены данные для мономерного аналога.
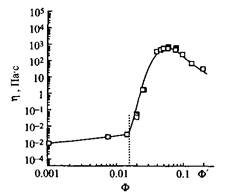
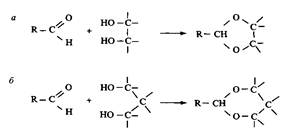
Рис. 7. Зависимость вязкости нулевого сдвига з от объемной доли Ц поверхностно-активного вещества в растворе при 20 °С. ПАВ — Ci2H25N2-2-N2Ci2H252+ 2ВГ Вязкость мицеллярных растворов ПАВ зависит от формы мицелл. В случае катионного димерного ПАВ с гидрофобными радикалами С12Н25 и мостиком из двух метиленовых групп обнаруживается резкое увеличение вязкости при 2%-ной концентрации. Из рис. 7 видно, что вязкость изменяется на 6-7 порядков в очень узком концентрационном интервале. Это изменение намного больше изменений вязкости в зависимости от концентрации, характерных для обычных катионных ПАВ, и связано с резким переходом от сферических мицелл к червеобразным мицеллам. Это характерное свойство димерных ПАВ с короткими мостиками. Такой переход и увеличение вязкости можно индуцировать наложением сдвигового напряжения даже при более низких концентрациях, чем в статических условиях. Необычные реологические свойства димерных ПАВ могут найти важные практические применения. Димерные ПАВ являются в настоящее время объектом многочисленных исследований, результаты которых позволяют предсказать, что их особые свойства, а также резкое повышение вязкости при увеличении концентрации) найдут широкое применение в практических целях. Высокая эффективность и низкие значения KKM привели к исследованию возможностей их использования для солюбилизации разнообразных веществ. В модельных опытах с использованием в качестве солюбилизата углеводородов обнаружено, что димерные ПАВ обладают большей солюбилизационной способностью, нежели обычные ПАВ. Димерные ПАВ вследствие их плотной упаковки на границах раздела фаз представляют интерес как потенциальные смазочные агенты. Много усилий направлено на создание молекул с заданной геометрией с помощью специфической геометрии димерных ПАВ. Такие ПАВ образуют везикулы и жидкокристаллические фазы в широкой области концентраций. Это свойство перспективно для практического использования. Примером может служить изготовление мезопористых молекулярных сит. Используя димерные ПАВ в качестве темплат, получили материалы кубической структуры с заданными размерами пор. 2. Поверхностно-активные вещества с разрушаемыми связями: привлекательность с экологической и других точек зрения Молекулы традиционных ПАВ весьма устойчивы. Среди ПАВ, используемых в быту, неионных, катионных, химически нестойкими в обычных условиях являются только алкилсульфаты. В течение многих лет чувствительность алкилсульфатов к кислотному гидролизу рассматривалась как серьезная проблема. В частности, с ней сталкиваются исследователи и потребители в случае самого известного представителя этого класса ПАВ — додецил-сульфата натрия. Общее убеждение состояло в том, что слабые гидроли-зующиеся связи в молекулах ПАВ могут быть причиной многих проблем при их использовании и хранении. Следовательно, ставилась задача устранять такие связи. В последние годы отношение к легко разрушающимся связям в молекулах ПАВ изменилось. Стремление защитить окружающую среду стало основным фактором при создании новых ПАВ, а скорость биоразложения стала важнейшим критерием. Одним из главных подходов, используемых для создания ПАВ с быстрым биоразложением, стало введение в их молекулы связей с ограниченной стабильностью. Из практических соображений слабую связь в молекулах ПАВ вводят в виде группировки, соединяющей полярную группу и гидрофобный радикал. Это означает, что в результате разрушения молекул сразу исчезает их поверхностная активность. Затем различными путями, которые в основном определяются типом продукта первичного разложения, происходит процесс биоразложения. Важнейшей характеристикой этого процесса является предельное разложение поверхностно-активного вещества, которое определяется количеством углекислого газа, выделяющегося в течение четырех недель в реакторе под действием специфических микроорганизмов. Предельное разложение ПАВ с лабильными связями выше, чем н ПАВ. не солепжаших таких связей. Обшая тенденция к использованию экологически безопасных продуктов обусловливает развитие производства ПАВ с лабильными связями. Вторая причина для развития этого направления заключается в необходимости устранения трудностей, связанных с пенообразованием или нежелательным образованием устойчивых эмульсий при использовании композиций ПАВ. По-видимому, использование ПАВ с лабильными связями позволит в какой-то мере решить эти проблемы. Если лабильная связь в молекуле ПАВ находится между полярной группой и гидрофобным радикалом, разрыв этой связи приведет к образованию одного растворимого в воде продукта и второго — гидрофобного, не растворимого в воде. Очистку от обоих компонентов можно легко провести, пользуясь стандартными методиками. Этот подход особенно интересен в случае использования ПАВ в препаративной органической химии и во многих биохимических процессах. В-третьих, перспективность использования ПАВ с ограниченной стабильностью заключается в возможности придания продуктам разложения новых полезных свойств. Например, поверхностно-активное вещество, входящее в состав композиций для личной гигиены, распадается с образованием продукта, полезного для ухода за кожей. Такие ПАВ иногда называют «функциональными» ПАВ. Наконец, ПАВ, распадающиеся заданным образом на вещества, не обладающие поверхностной активностью, могут представлять интерес в специальных областях, например в биомедицине. Так, лабильные ПАВ, образующие везикулы или микроэмульсии, можно использовать при создании носителей для контролируемой доставки лекарственных веществ. В большинстве случае лабильные ПАВ содержат в молекулах легко гидроли-зующиеся связи. Химический гидролиз катализируется кислотами или щелочами и достаточно хорошо изучен. В окружающей среде гидролиз лабильной связи происходит под действием ферментов, которые в этом случае выступают катализаторами процесса гидролиза. Следует сказать, что in vitro ферментативный гидролиз ПАВ с лабильными связями исследован далеко не полно. Существуют другие подходы, в которых для получения ПАВ с лабильными связями в молекулы включают связи, разрушающиеся под действием ультрафиолетового излучения или при озонировании. Ниже рассматриваются все указанные типы лабильных связей. Лабильные ПAB, гидролизующиеся в кислой среде Циклические ацетали Лабильные ПАВ, производные циклических ацеталей — 1,3-диоксалана и 1,3-диоксана, представлены на рис. 8. Эти ПАВ гидролизуются в кислой среде. Их обычно синтезируют из длинноце-почечных альдегидов при взаимодействии с диолами или полиолами. Взаимодействие альдегидных групп с вицинальными гидроксигруппами приводит к образованию диоксолана, а взаимодействие с 1,3-диолами — к образованию диоксана.
Рис. 8. Получение 1,3-диоксолановых и 1,3-диоксановых ПАВ из длинноцепочечных альдегидов и 1,2- и 1,3-диолов соответственно Если реакцию проводить не с диолами, а с глицерином, образуется гидрокси-ацеталь. Соответственно модифицируя оставшуюся свободной гидроксильную группу, можно получить анионное или катионное ПАВ. В результате взаимодействия с глицерином образуется диоксолановое кольцо со свободной первичной гидроксильной группой, но может также образоваться и диоксановое кольцо со свободной вторичной группой. На свободные гидроксигруппы действуют SO3, нейтрализуют и получают сульфатное ПАВ; при обработке пропан-сультоном получают сульфонатное ПАВ. Гидроксильные группы можно заместить бромом или хлором, а затем по реакции с диметиламином получить катионное ПАВ с третичным амином в качестве полярной группы. Получение четвертичного аммония можно провести обычными способами, например реакцией с метилбромидом. Свободную гидроксильную группу можно также эток-силировать, при этом получится неионное ПАВ с лабильной группой. Скорость разложения таких неионных ПАВ в отстойниках очистной станции намного превышает скорость разложения обычных этоксилатов.
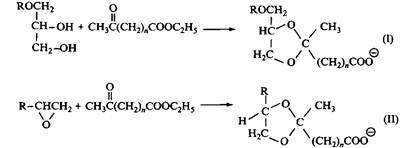
Рис. 9. Примеры 1,3-диоксоланоых ПАВ: — анионное ПАВ, — катионное ПАВ В результате гидролиза циклические ацетали превращаются в альдегиды, которые являются промежуточными продуктами в процессе биохимического в-окисления углеводородных цепей. Кислотный гидролиз незамещенных ацеталей при комнатной температуре происходит довольно легко и с высокими скоростями при рН 4-5. Электроноакцепторные заместители типа гидроксильной группы, эфирного кислорода и галогенов замедляют скорость гидролиза. Анионные ацетальсодержащие ПАВ более лабильны, чем соответствующие катионные ПАВ. Этот результат можно объяснить высокой локальной активностью ионов гидроксония вокруг мицелл анионных ПАВ. Такой же эффект наблюдается и для ПАВ, образующих везикулы, вокруг которых активность ионов гидроксония повышается. Ацетальсодержащие ПАВ устойчивы в нейтральной среде и при высоких значениях рН. 1,3-Диоксолановое кольцо, как было установлено, приблизительно соответствует двум оксиэтиленовым единицам по влиянию на KKM и адсорбцию. ПАВ типа I подобны сульфатным эфирам с общей формулой R-20S03Na. Это очень интересно, поскольку промышленные сульфаты алкильных эфиров содержат две-три оксиэтильные группы. Ациклические ацетали Алкилглюкозиды, которые иногда ошибочно относят к алкилполиглюкозидам, представляют собой циклические соединения. Поскольку в этом случае геминальные гидроксильные группы гидратированного альдегида не входят в цикл, мы включаем их в группу ациклических ацеталей. Алкилглюкозиды это самые важные представители ацетальсодержащих ПАВ. Алкилглюкозидные ПАВ гидролизуются в кислых средах с образованием глюкозы и длинноцепочечного спирта. Они абсолютно устойчивы в щелочных средах даже при очень высоких значениях рН. Особенности расщепления таких ПАВ наряду с относительно простым синтезом делают их весьма привлекательными в составе чистящих композиций. Расщепляющиеся ПАВ на основе полиэтиленоксида были синтезированы по реакции защищенных полиэтиленгликолей с длинноцепочечным альдегидом. В процессе кислотного гидролиза такие соединения распадаются на исходные вещества — алкилальдегид и защищенный ПЭГ. В результате исследований гидролиза было установлено соответствие между структурой и неустойчивостью соединений к гидролизу. Скорость гидролиза увеличивается с уменьшением длины гидрофобной части ПАВ при постоянстве полярной группы, что объясняется уменьшением гидрофобного экранирования ацетальной связи от ионов гидроксония. Варьирование полярных групп при постоянстве гидрофобной части не оказывает влияния на скорость гидролиза. Скорость гидролиза ацеталированного ПАВ также не зависит от структуры гидрофобной части. Скорость гидролиза свободных молекул ПАВ всегда выше, чем молекул, включенных в мицеллы. Ацеталированные ПАВ по физико-химическим свойствам очень близки к обычным ПАВ. Однако значения KKM ацетальсодержащих ПАВ всегда немного ниже, чем KKM соответствующих обычных ПАВ. Кроме того, их эффективность, выраженная концентрацией, необходимой для снижения поверхностного натяжения на 20 мН/м, оказалась выше. Это безусловно указывает на то, что аце-тальные связи между гидрофобным радикалом и полярной группой дают определенный вклад в гидрофобность молекул ПАВ, повышая их поверхностную и адсорбционную активность на границе раствор-воздух, а также усиливают склонность к мицеллообразованию. Кетали Поверхностно-активные вещества, содержащие кетальные связи, можно получить из длинноцепочечных кетонов и диолов по аналогии с реакциями, приведенными на рис. 8 и 9. Неионные расщепляющиеся ПАВ на основе длинноцепочечных карбонильных соединений, глицерина и полиэтиленоксидных цепей уже получают в промышленном масштабе. Можно исходить из длинноцепочечных кетонов или альдегидов, которые образуют соответственно кетали или ацетали в реакциях конденсации с глицерином, как уже упоминалось при обсуждении циклических ацеталей. Из кетонов прежде всего получают 4-гидроксиметил-1,3-диоксоланы, а из альдегидов — смесь 4-гидроксиметил-1,3-диоксоланов и 5-гидрокси-1,3-диоксанов. Остающуюся гидроксильную группу алкоксилируют в присутствии основного катализатора. Кетальсодержащие ПАВ с хорошим выходом получают из эфиров кетокис-лот двумя возможными способами. Кривые биоразложения диоксо-лановых ПАВ, показанных на рис. 10, приведены на рис. Как и следовало ожидать, скорость разложения сильно зависит от длины алкильной цепи. Процесс биоразложения протекает намного быстрее для лабильных ПАВ, чем для обычных карбоксилатных ПАВ при одинаковой длине алкильной цепи. В особенности это касается соединений со структурой I, содержащей один дополнительный атом кислорода. Кетальсодержащие ПАВ, как правило, более лабильны, чем соответствующие ПАВ, содержащие ацетальные группы. Например, одинаковая степень гидролиза кетальсодержащих и ацетальсодержащих ПАВ достигается в первом случае при рН 3.5, а во втором — только при 3.0. Относительная лабильность кетальной связи обеспечена более высокой стабильностью карбокатиона, образующегося при гидролизе кеталей, по сравнению со стабильностью карбокатиона, образующегося при гидролизе ацеталей. При этом биоразложение ацетальсодержащих ПАВ протекает быстрее, чем кетальсодержащих ПАВ, если сравнивать очень близкие по структуре ПАВ. По-видимому, прямой корреляции между скоростями биоразложения и химического гидролиза не существует.
Рис. 10. Получение анионного 1,3-диоксоланового ПАВ из этиловых эфиров кетокислот
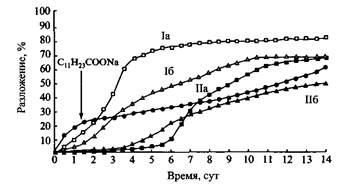
Рис. Зависимость степени биоразложения четырех кетальных ПАВ и взятого для сравнения додеканоата натрия от времени. I и II — соединения, представленные на рис. 10; а — R=Cns, з = 2; б R=Ci6H33, з = 2 Ортоэфиры Ортоэфиры относятся к новому классу недавно полученных поверхностно-активных веществ. Ортоэфирные ПАВ получают переэтерификацией низкомолекулярного ортоэфира, например при взаимодействии триэтилортоформиата с жирным спиртом и полиэтиленгликолем. Структуры молекул типичных ортоэфирных ПАВ и способы их получения приведены на рис. 12.
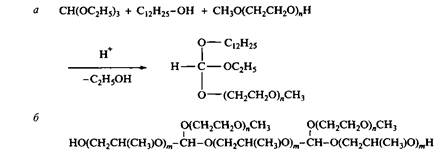
Рис. 12. Синтез и структура ортоэфирных ПАВ и ортоэфирных блок-сополимеров Из-за трифункциональности ортоэфира получается набор веществ. Более того, если вступающий в реакцию спирт содержит две гидроксильные группы, возникают многочисленные поперечные сшивки с образованием протяженных сетчатых структур. Такие соединения являются эффективными пеногасителями. Пример такого вещества, состоящего из блоков полипропиленгликоля и ПЭГ, приведен на рис. 12. Варьированием числа и типа заместителей можно получать ортоэфирные ПАВ с заранее заданными свойствами для определенных областей применения. Гидролиз ортоэфиров протекает по механизму, аналогичному механизму гидролиза ацеталей и кеталей. В результате гидролиза образуется один моль формиата и два моля спирта. Оба эти компонента нетоксичны. Недавно было установлено, что поверхностно-активные формиаты не оказывают нежелательных дерматологических воздействий. Тесты включали определение сенсибилизирующей емкости и раздражающего действия. При одних и тех же условиях степень кислотного гидролиза ортоэфирных ПАВ всегда выше, чем у ацеталированных ПАВ. В частности, водорастворимое ортоэфир-ное ПАВ, полученное из октанола и монометил-ПЭГ, гидролизуется на 50% в течение 2 ч при рН 5. Структура ПАВ влияет на скорость гидролиза, так что более гидрофильное ПАВ гидролизуется с более высокой скоростью. Ортоэфирные связи можно использовать для усиления биоразлагаемости длинноцепочечных этоксилатов или блок-сополимеров. Обычный блок-сополимер ПЭГ — ППГ с молекулярной массой 2200 распадается только на 3% за 28 дней в условиях биоразложения. В то же время биоразложение соединения, построенного из блоков ПЭГ-350 и ППГ-400, соединенных орто-эфирными связями, происходит на 62% за 28 дней, и такое ПАВ можно классифицировать как легко биоразлагаемое ПАВ. Лабильные ПAВ, гидролизующиеся в щелочной среде Нормальные сложные эфиры четвертичных аммониевых солей Название сложные эфиры четвертичных аммониевых солей относится к соединениям общей формулы ILN+X, в которых длинноцепочечные радикалы R присоединены к заряженной группе через сложноэфирную связь. Под нормальными эфирами ЧАС подразумеваются ПАВ, молекулы которых состоят из сложных эфиров одной или более жирной кислоты и кватернизированного ами-носпирта. На рис. 13 в качестве примеров приведены три эфира ЧАС, содержащие у атома азота по два длинноцепочечных и два короткоцепочечных заместителя. На этом рисунке приведено также исходное ПАВ — ЧАС, не содержащее лабильной связи. Видно, что молекулы таких ПАВ содержат два атома углерода между сложноэфирной связью и атомом азота, несущим положительный заряд. Гидролиз сложноэфирной связи в соединениях II-IV приводит к образованию солей жирных кислот и хорошо растворимых в воде двух- или трехатомных кватернизированных аминоспиртов. Эти продукты обнаружили низкую токсичность в тестах на рыбах. Дальше они разрушаются по установленному метаболизму. В целом по экологическим тестам сложные эфиры ЧАС гораздо лучше обычных ЧАС.
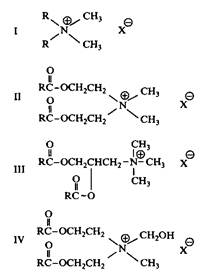
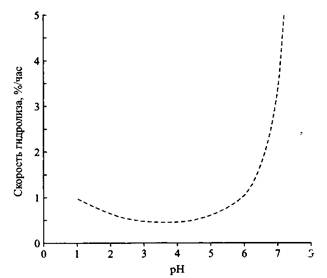
Рис. 13. Структуры обычного четвертичного аммониевого ПАВ и трех сложных эфиров ЧАС; R длинная алкильная цепь, X — Cl, Br или CH3SO4 В последние 10-15 лет диалкилэфирные ЧАС заметно вытесняют устойчивые диалкильные ЧАС в качестве мягчителей в промывочных циклах, что составляет самую большую область применения четвертичных аммониевых соединений. Отказ от устойчивых диалкильных ЧАС и переход на использование диалкилэфирных ЧАС представляет наиболее значительное изменение типа продукта в истории ПАВ и всецело связан с защитой окружающей среды. В отличие от устойчивых ЧАС эфирные ЧАС характеризуются прекрасными показателями биоразлагаемости и токсичности в водной среде. Эти ПАВ полностью или частично вытеснили обычные ЧАС и в других областях применения катионных ПАВ, например в средствах ухода за волосами и других промышленных композициях. Катионный заряд вблизи сложноэфирной связи делает нормальные эфиры ЧАС необычайно стабильными в кислых и лабильными в щелочных средах. Такая сильная зависимость от рН может быть использована для инициирования быстрого разложения ПАВ. Этот эффект еще больше проявляется у эфиров бетаина. Механизм их гидролиза подробно обсуждается ниже. Зависимость от рН скорости гидролиза эфиров ЧАС показана на рис. 14. Видно, что скорость гидролиза минимальна при рН 3-4 и резко увеличивается при рН выше 5-6. Понятно также, что композиции, содержащие сложные эфиры ЧАС, должны использоваться при низких рН.
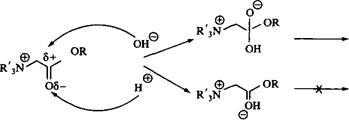
Рис. 14. Влияние рН на гидролитическую стабильность дицетилового сложного эфира хлорида бисаммония при 25°С Эфиры бетаина Скорость щелочного гидролиза зависит от расположенных близко к эфирной связи электроноакцепторных или электронодонорных групп. Четвертичная аммониевая группа является сильным акцептором электронов. Индуктивный эффект приводит к снижению электронной плотности на сложноэфирной связи, что облегчает инициирование щелочного гидролиза, который начинается с нук-леофильной атаки гидроксильными ионами углерода карбонильной группы. Соединения II-IV содержат по два атома углерода между аммониевым азотом и кислородом эфирной связи. Скорость щелочного гидролиза таких эфиров превосходит скорости гидролиза эфиров, не имеющих соседних зарядов, хотя различие не очень велико. Если же заряд расположен с другой стороны эфирной связи, скорость гидролиза существенно увеличивается. Такие эфиры чрезвычайно лабильны в щелочной среде и очень устойчивы в сильнокислой. Столь значительное влияние аммониевой группы на скорости щелочного и кислотного гидролиза обусловлено явлениями стабилизации / дестабилизации основного состояния. Отталкивание положительно заряженного атома углерода карбонильной группы и положительно заряженного атома азота ослабляется атакой ионов гидроксила и увеличивается при протонировании. Суммарный эффект заключается в том, что по сравнению со сложными эфира-ми, не имеющими катионного заряда, скорость щелочного гидролиза увеличивается в 200 раз, а скорость кислотного гидролиза уменьшается в 2000 раз. Для поверхностно-активных сложных эфиров бетаина и динноцепочечных алифатических спиртов скорость щелочного гидролиза увеличивается еще больше, поскольку протекает по механизму мицеллярного катализа. Однако присутствие крупных, поляризуемых противоионов, например бромид-ионов, может полностью выключать мицеллярный катализ.
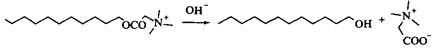
Рис. 15. Механизм кислотного и щелочного гидролиза эфиров бетаина Исключительно сильная зависимость от рН поведения поверхностно-активных эфиров бетаина делает их чрезвычайно перспективными разрушающимися катионными ПАВ. Время их жизни в кислотных средах очень большое, а скорость гидролиза зависит от рН, при которых эти вещества используются. Одно-цепочечные ПАВ этого типа были предложены в качестве «временных» бактерицидов в средствах гигиены, для дезинфекции в пищевой промышленности и в других отраслях, где требуется кратковременное бактерицидное действие. Распад эфира бетаина, обладающего бактерицидным действием, с образованием безвредных продуктов показан на рис. 16. В патентной литературе описаны сложные эфиры бетаина с двумя длинноцепо-чечными алкильными группами. Другие сложные эфиры Как уже упоминалось, одной из целей использования ПАВ с ограниченной устойчивостью является получение продукта распада, обладающего новыми свойствами. Рис. И. 17 иллюстрирует эту концепцию: ПАВ с хорошим моющим действием разрушается в щелочной среде с образованием гидрофобного алифатического спирта. ПАВ такого типа представляют интерес для комбинации чистки и гидрофобизации, например при чистке палаток, плащей и т. д. При соответствующем контроле рН этих композиций текстильные изделия стираются и гидрофобизируются в одностадийном процессе. Наиболее часто используемый путь получения разрушающихся ПАВ заключается в введении в молекулы связей, лабильных в кислых или щелочных средах.
Рис. 16. Щелочной гидролиз катионного ПАВ, обладающего бактерицидным действием, с образованием алифатического спирта и бетаина
Рис. 17. Щелочной гидролиз анионного ПАВ с образованием гидрофобного алифатического спирта и водорастворимого малеата Разрабатываются и другие подходы. Например, были получены и исследованы ПАВ, разрушающиеся при облучении ультрафиолетом. В результате фотохимического разрушения образуются соединения, не обладающие поверхностной активностью. Такой подход представляет интерес, поскольку он позволяет достичь максимально быстрого разложения ПАВ. Особый интерес фотолабильные ПАВ представляют при использовании их в качестве эмульгаторов в процессах эмульсионной полимеризации. Использование фотолабильных эмульгаторов открывает возможность простого контроля за процессом коагуляции латексов путем облучения влажной пленки ультрафиолетом. Ионные полярные группы ПАВ отщепляются в результате фотолиза, приводя к агрегированию частиц латекса. Для таких целей были предложены ПАВ с диазосульфонатной полярной группой. При ультрафиолетовом облучении диазо-связь разрушается, и ПАВ разлагается с образованием сульфит-иона и гидрофобного остатка, не обладающих поверхностной активностью. Этот подход также перспективен, поскольку ультрафиолетовое облучение часто используется при создании разнообразных покрытий. Другой пример УФ-лабильных ПАВ — двухцепочечные ПАВ, содержащие Co в качестве комплексообразующего агента для двух одноцепочечных ПАВ с этилендиаминовыми полярными группами. УФ-Облучение или просто солнечный свет вызывают восстановление Co до Co. Последний образует очень лабильный комплекс, и двухцепочечное ПАВ мгновенно разлагается на два одноцепочечных остатка. В качестве примеров экологически безопасных ПАВ были синтезированы озон-лабильные соединения. Такие ПАВ, содержащие ненасыщенные связи, легко разрушаются при озонировании воды, которое становится важнейшим способом ее очистки. Вполне вероятно, что в ближайшем будущем будут разработаны новые методы разрушения ПАВ в окружающей среде, основанные на создании новых структур ПАВ с хорошими экологическими показателями. |
|
|
| 17.06.2012 |
| Большое обновление Большой Научной Библиотеки |
| 12.06.2012 |
| Конкурс в самом разгаре не пропустите Новости |
| 08.06.2012 |
| Мы проводим опрос, а также небольшой конкурс |
| 05.06.2012 |
| Сена дизайна и структуры сайта научной библиотеки |
| 04.06.2012 |
| Переезд на новый хостинг |
| 30.05.2012 |
| Работа над улучшением структуры сайта научной библиотеки |
| 27.05.2012 |
| Работа над новым дизайном сайта библиотеки |