|
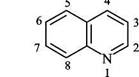
Курсовая работа: Методы синтеза хинолинов и изохинолиновКурсовая работа: Методы синтеза хинолинов и изохинолиновСанкт-Петербургский Государственный Университет Химический Факультет Курсовая работа по органической химии Тема: Методы синтеза хинолинов и изохинолинов Работу выполнила: студентка 3-го курса Бутаева Е.В. Работу проверил: Новиков М.С. Санкт-Петербург 2008 Введение Хинолин - гетероциклические соединение, в котором бензольное кольцо аннелировано с пиридином через атомы углерода. Соединение первоначально было выделено из каменноугольной смолы. Хинолиновая циклическая система широко распространена в природе. Алкалоид хинин, традиционно использующийся в качестве противомалярийного средства, также обладает тонизирующим эффектом. Хннолиновый скелет в течение длительного времени служил основой для поиска синтетических противомалярийных препаратов. Один из таких препаратов - хлорохин. Цианиновые красители также составляют значительную долю в коммерческой продукции на основе хинолинового сырья. Тетрагидропроизводное оксамнихин используется для борьбы с шистосомой, которая служит основной причиной заболеваний в тропических регионах. После модификации молекулы хинолина (или нафтиридина) путем введения в нее атома фтора появились антимикробные препараты с уникальными свойствами, которые получили обобщенное название "фторхинолоны". В настоящее время группа фторхинолонов по количеству современных антимикробных лекарственных средств уступает только -лактамным антибиотикам. Большая номенклатура препаратов группы фторхинолонов свидетельствует об их значении для лечения бактериальных инфекций. В настоящее время фторхинолоны занимают одно из ведущих мест в химиотерапии инфекций различного генеза и локализации. После появления первого фторхинолона (норфлоксацин) были синтезированы многочисленные соединения этого ряда и значительная часть из них (около 15 препаратов) дошла до клинического использования, однако не все из них получили широкое применение. Опийный алкалоид папаверин обладает способностью расслаблять гладкую мускулатуру и расширять сосуды. Существует также несколько других семейств изохинолиновых алкалоидов, которые часто встречаются в растениях, произрастающих в Великобритании; предшественником всех этих соединений в природе служит тирозин. Глава I Хинолины
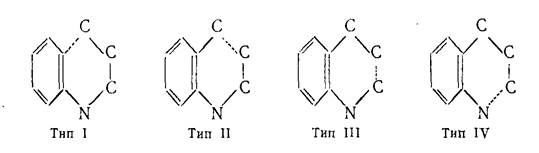
Большинство синтезов, ведущих к образованию хинолиновой циклической системы, состоит в замыкании пиридинового цикла по одному из четырёх возможных путей:
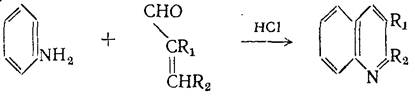
Образование связи по типу I 1. Синтез Дебнера-Миллера Представляет собой наиболее общий метод из методов типа I. В синтезе Дёбнера-Миллера используют α,β-ненасыщенные альдегиды и кетоны. Это существенно расширяет возможности метода при синтезе различных производных хинолина, содержащих заместители в пиридиновом кольце. В качестве конденсирующего агента используется НС1 и ZnCl2. В этом варианте синтеза также необходима стадия окисления дигидрохинолина (дегидрирование происходит за счет переноса водорода к основанию Шиффа, присутствующему в реакционной среде). Было показано,что эта реакция применима почти для всех ароматических аминов. В качестве альдегида может быть взят любой α,β-ненасыщенные альдегид, подобный кротоновому или коричному. Общее течение реакции изображается схемой:
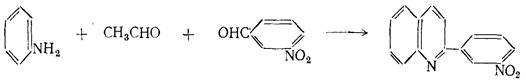
Применение метода Дёбнера-Миллера в случае смеси альдегидов, очевидно, ограничено реакциями конденсации, протекающими преимущественно в одном направлении. Таким образом, большинство синтезов, в которых применяется смесь альдегидов, осуществлено с ароматическими и жирными альдегидами. В этом случае преобладает одно направление конденсации. В качестве примера можно привести конденсацию с участием уксусного альдегида и м-нитробензальдегида:
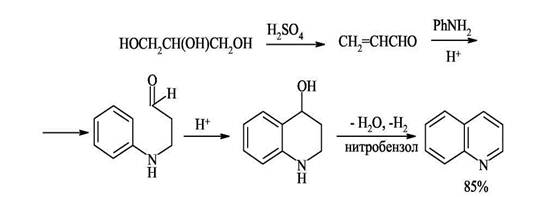
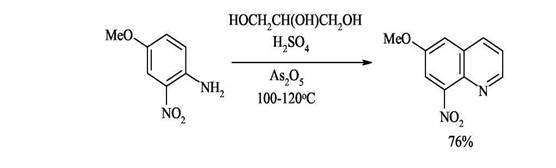
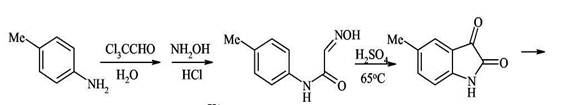
2. Синтез Скраупа - конденсация ариламинов с α,β-непредельными карбонильными соединениями. Этот синтез подбно синтезу Дёбнера-Миллера протекает через стадию образования дигидрохинолинового производного. Различие методов состоит в применении разных реагентов, при помощи которых завершается дигидрирование промежуточного продукта, дигидрохинолина, в хинолин. В методе Дёбнера-Миллера таким реагентом является образующееся из первоначально взятых веществ шиффово основание, которое способно присоединять водород и тем самым завершить дегидрирование. В реакции Скраупа дегидрирование завершается при помощи специально прибавляемого реагента. По методу Скраупа ароматический амин, по меньшей мере с одним свободным орто-положением по отношению к амино группе, нагревается с глицерином, серной кислотой (которая действует как дегидратирующий агент и катализатор) и окислителем. В простейшем случае, когда в качестве амина взят анилин, а в качестве окислителя-нитробензол, реакцию можно изобразить следующей схемой:
Дегидратация глицерина приводит к образованию а,β-непредельного альдегида -акролеина. В дальнейшем, по-видимому, происходит присоединение анилина по Михаэлю к активированной двойной связи акролеина. Последующее электрофильное замыкание цикла требует кислотного катализа. Для окисления образующейся гидрированной структуры используют нитробензол того же строения, что и исходный анилин. Реакция сильно экзотермична, поэтому обычно добавляют замедлитель процесса - сульфат железа(П). Как и в реакции Дебнера-Миллера, здесь может образоваться промежуточное шиффово основание. Это ни в коей мере не может отразиться на течении реакции, так как первичным продуктом циклизации является дигидрохинолин. Совершенно несущественно, как он образуется: в результате внутримолекулярного отщепления воды или анилина. Этим методом нельзя синтезировать соединения, содержащие группировки, чувствительные к действию кислот. Это единственное ограничение данного метода, являющегося лучшим способом синтеза хинолинов, не замещённых в гетероциклическом кольце.
3. Синтез Комба - конденсация ариламинов с 1,3-дикарбонильными соединениями Конденсация 1,3-дикарбонильного соединения с ароматическим амином даёт с высоким выходом β-аминоенон, который циклизуется под действием концентрированной кислоты. Эта стадия представляет собой электрофильное замещение мезомерного О-протонированного аминоенона, а последующее отщепление молекулы воды приводит к образованию ароматического хинолина.
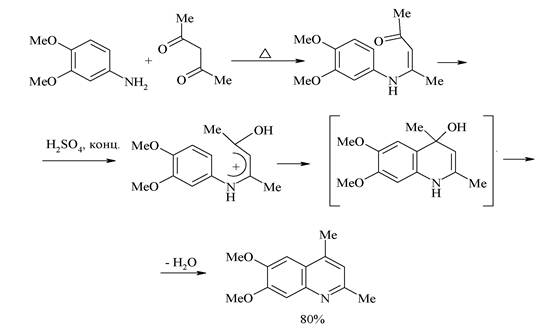
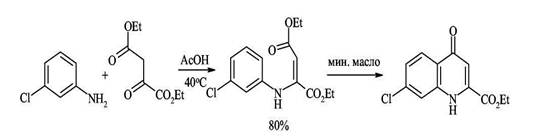
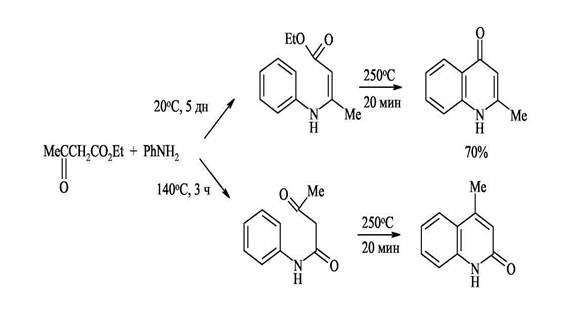
4. Синтез Конрада-Лимпаха-Кнорра — конденсация ариламинов с β-кетоэфирами Этот близкий предыдущему метод основан на конденсации ариламинов с β-кетоэфирами и приводит к хинолонам. В кетоэфирах имеются карбонильные группы двух типов и аминогруппа ароматических аминов конденсируется с наиболее активной карбонильной группой кетона. Полученный β-аминоакриловый эфир при 250 С циклизуется в 4-хинолон.
Интересно отметить, что при использовании ацетоуксусного эфира в зависимости от условий реакции могут образовываться 2-метилхинолоны-4 или 4-метилхнолоны-2. Атака аминогруппы по кетонному карбонилу (образование 2-метилхинолонов-4) кинетически контролируемый процесс, который протекает при низких температурах (~ 20°С). Атака по сложноэфирной группе предпочтительна термодинамически и происходит, когда реакцию ведут при 110-140°С (образование 4-метилхинолона-2). Полученный продукт конденсации циклизируется с образованием изомерного 2-хинолона. Таким образом этот синтез позволяет контролировать направление циклизации.
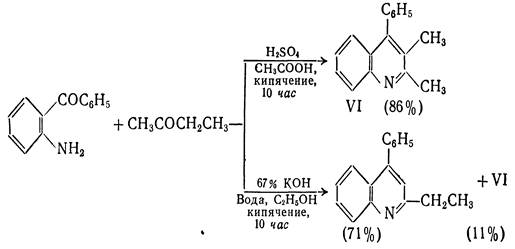
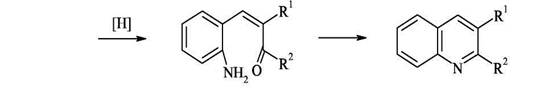
50% Образование связи по типу II 1. Синтез из орто-ациланилинов и карбонильных соединений, содержащих α- метиленовую группу (синтез Фридлендера). Хинолины можно получить конденсацией орто-ациланилинов с кетонами или альдегидами(последние должны содержать α-метиленовую группу), катализируемой кислотами или щелочами. Формально такого типа конденсация заключается в образовании основания Шиффа и последующей конденсации альдольного типа с участием арильного карбонила и активной метиленовой группы.
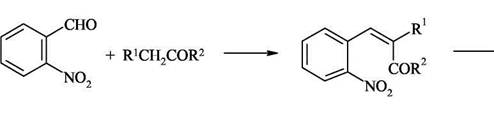
Из выше приведённых примеров видно, что ориентация конденсации, а следовательно, и циклизации зависит от условий реакции. В кислой среде карбонильное соединение реагирует в виде нейтрального С3-енола, в щелочной - в виде С1-енолят аниона. Аналогичные закономерности наблюдаются и при альдольной конденсации метилэтилкетона в средах различной кислотности и основности. Поскольку орто-ациланилины труднодоступны, используют конденсацию орто-нитрокарбонильных предшественников с активными метиленовыми компонентами с последующей восстановительной циклизацией.
2.Синтез Пфитцингера Предыдущий синтез основан на применении малодоступных орто-бензальдегидов, и в этом варианте метода Фридлендера вместо них используют гораздо более доступные замещённые изатины. Синтез Пфитцингера заключается в щелочным гидролитическом раскрытии пятичленного кольца изатина и последующей конденсации образующегося аниона орто-аминофенилглиоксиловой кислоты с кетонами. Исходный изатин легко и высокими выходами на всех стадиях можно получать из доступных реагентов:
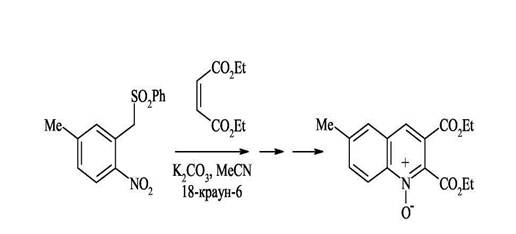
3.Конденсация орто-нитроарилбензилсульфонов с эфирами малеиновой или фумаровой кислот Исходные орто-нитробензиларилсульфоны очень удобно получать по реакции викариозного нуклеофильного замещения. Наличие в исходных структурах сульфонильной группы, обладающей способностью легко элиминироваться в виде арилсульфоновой кислоты, позволяет сразу получать ароматические структуры, не прибегая к дополнительному окислению. Процесс идет через несколько стадий и завершается образованием N-оксида 2,3-ди(этоксикарбонил)хинолина.
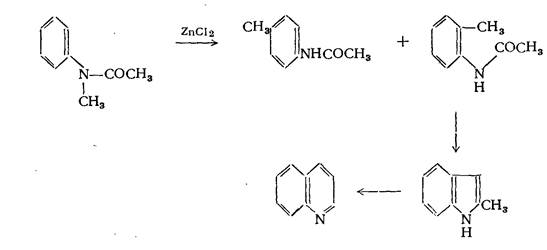
Образование связи по типу III 1. Реакция Бунзла Реакция, при которой в качестве конечного продукта образуется хинальдин:
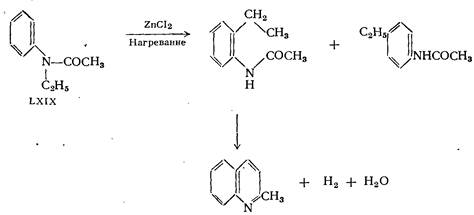
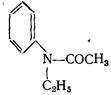
При нагревании N-ацетиэтиланилина с хлористым цинком наряду с пара-этилацетанилидом образуются небольшие количества хинальдина. Течение реакции может быть уяснено, если допустить, что под влиянием хлористого цинка происходит мигрирование этильной группы в соединении:
частично в орто- и частично в пара-положение. N-ацетилметиланилин в аналогичной реакции даёт хинолин. Образование хинолина в этой реакции нельзя объяснить таким же образом, как и образование хинальдина в приведённой выше реакции. Было высказано предположение, что образование хинолина может происходить через стадию получения 2-метилиндола.
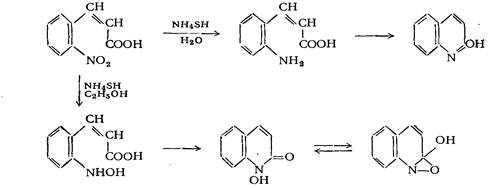
Образование связи по типу IV 1. Реакция Чиоза Это одна из первых известных реакций замыкания хинолинового цикла, которая заключается в образовании карбостирила при восстановлении о-нитрокоричной кислоты:
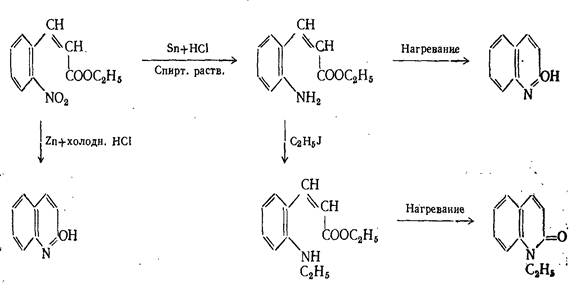
Вместо гидросульфида аммония в качестве восстановительного агента может быть применена гидроокись двухвалентного железа. 2. Синтезы на основе превращений этилового эфира о-нитрокоричной кислоты
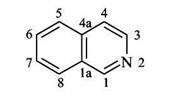
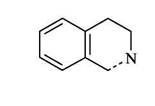
Глава II Изохинолины
Стратегии построения изохинолинового скелета:
C(1)-N
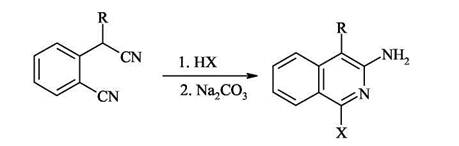
C(ia)-C(i) С(4)-С(4а) Образование связи C(1)-N Циклизация 2-цианобензилцианидов под действием галогенводородных кислот Этот региоселективный синтез изохинолинов идет по механизму динитрильной конденсации под действием НВг или HI (применение НС1 неэффективно).
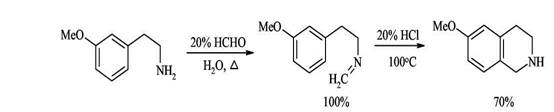
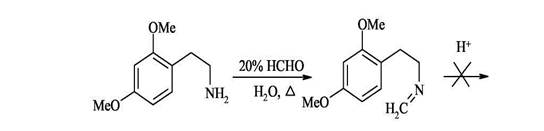
Образование связи C(1)-C(1a) 1. Синтез из активированных фенилэтиламинов с формальдегидом (синтез Пикте-Шпенглера) Образующиеся при взаимодействии фенилэтиламинов с альдегидами альдимины в кислой среде электрофильно циклизуются по бензольному кольцу с образованием 1,2,3,4-тетрагидроизохинолинов. Для успешного осуществления циклизации бензольное кольцо должно быть активировано к электрофильной атаке наличием электронодонорных заместителей, поскольку образующиеся при действии кислоты на имины иминиевые соли - достаточно слабые электрофилы.
Циклизация успешно идет при наличии донорных заместителей в пара-положении к месту атаки, если такие заместители расположены в других положениях бензольного кольца реакция не идет.
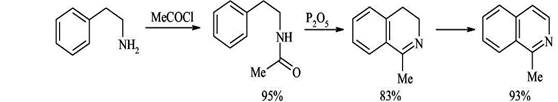
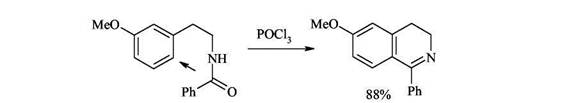
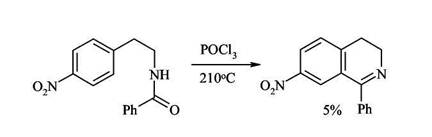
2. Циклизация ацилированных фенилэтиламинов (синтез Бишлера-Напиральского) Ацилированние фенилэтиламинов с последующей циклизацией под действием кислот Льюиса (Р2О5, PCl3, PCl5) приводит к 3,4-дигидроизохинолинам, легко дегидрирующимся в ароматические структуры. Циклизация в этом случае - обычный электрофильный процесс, поэтому она плохо идет при наличии в бензольном кольце электроноакцепторных заместителей.
Из мета-замещенных фенилэтиламинов образуются только 6-изомеры, то есть циклизация идет исключительно в пара-положение по отношению к заместителю.
При наличии электроноакцепторных заместителей в ядре даже в очень жестких условиях образуются лишь следы продукта циклизации:
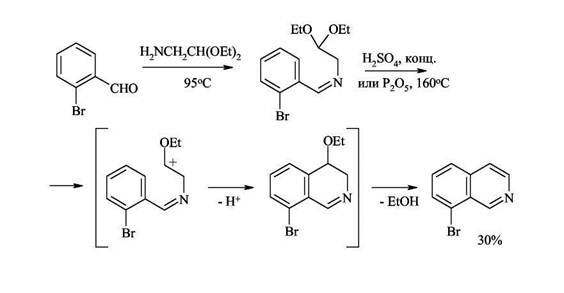
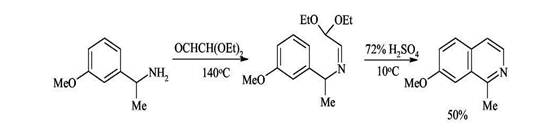
Образование связи(С4-С4а) 1. Синтез Померанца-Фрича — получение изохинолинов из бензальдегидов и аминоацеталей Синтез проводят в две стадии: 1) получение альдиминов за счет конденсации аминогруппы по карбонильной функции бензальдегида (в мягких условиях альдимины получают с высокими выходами). 2) циклизация альдиминов под действием сильных кислот.
Этот способ удачно дополняет два рассмотренных ранее метода синтеза изохинолинов, поскольку при его применении образуются замещённые изохинолины, которые не удаётся синтезировать другими путями. При замене ароматических альдегидов кетонами процесс протекает менее гладко. 2. Получение 1-замещенных изохинолинов из α-алкилбензиламинов и полуацеталя глиоксаля Изохинолины, замещенные по положению 1, трудно синтезировать по методу Померанца-Фрича, так как первая стадия - образование кетимина из аминоацеталя и кетона - идет не так гладко, как конденсация с бензальдегидом. Поэтому используют другой метод проведения реакции: замещенный бензиламин конденсируют с полуацеталем глиоксаля, образующийся имин циклизуют обычным способом.
В данном случае циклизация идет по пара-положению по отношению к активирующему заместителю, видимо, в силу его большей стерической доступности. Заключение В ходе проделанной работы, были выявлены основные и наиболее важные методы синтеза хинолинов и изохинолинов. В хинолинах возможно четыре типа построения скелета молекулы. В синтезах типа I замыкание цикла происходит между γ-углеродным атомом и бензольным ядром, в синтезах типа II замыкание цикла осуществляется между β- и γ-углеродными атомами, в синтезах типа III цикл замыкается между α- и β-углеродными атомами, и в синтезах типа IV замыкание цикла осуществляется между азотом и α-углеродным атомам. Кроме этих четырёх основных типов реакций, применяемых при синтезе хинолина, известны и многочисленные их разновидности. Следует иметь в виду возможность того, что иногда один тип синтеза перекрывается другим, так как точный механизм реакций в ряде случаев до конца не выяснен. Помимо указанных методов имеются некоторые другие методы получения хинолиновых производных. К ним относятся реакции окисления полициклических соединений, а также некоторые пиролитические методы. Список литературы: 1. «Химия гетероциклических соединений» Т. Джилкрист 2. «Основы современной химии гетероциклических соединений» Дж. Джоуль, Г. Смит 3. «Гетероциклические соединения» под ред. Эльдерфилда (том трерий) 4. «Гетероциклические соединения» под ред. Эльдерфилда (том четвёртый) 5. «Основы современной химии гетероциклических соединений» Л. Пакетт 6. «Гетероциклические соединения» Пожарский 7. «Химия гетероциклических соединений» Иванский В.И. |
|
|
| 17.06.2012 |
| Большое обновление Большой Научной Библиотеки |
| 12.06.2012 |
| Конкурс в самом разгаре не пропустите Новости |
| 08.06.2012 |
| Мы проводим опрос, а также небольшой конкурс |
| 05.06.2012 |
| Сена дизайна и структуры сайта научной библиотеки |
| 04.06.2012 |
| Переезд на новый хостинг |
| 30.05.2012 |
| Работа над улучшением структуры сайта научной библиотеки |
| 27.05.2012 |
| Работа над новым дизайном сайта библиотеки |