|
Курсовая работа: Подготовка и конденсация водыКурсовая работа: Подготовка и конденсация водыКурсовая работа “Подготовка и конденсация воды” Одесса 2010 Введение В настоящее время вода широко используется в различных областях промышленности в качестве теплоносителя и рабочего тела, чему способствует широкое распространение воды в природе и ее особые термодинамические свойства, связанные со строением молекул. Полярность молекул воды, характеризуемая дипольным моментом, определяет большую энергию взаимного притяжения молекул воды (ориентационное взаимодействие) при температуре 10…30 С и соответственно большую теплоту фазового перехода при парообразовании, высокую теплоемкость и теплопроводность. Значение диэлектрической постоянной воды, также зависящей от дипольного момента, определяет своеобразие свойств воды как растворителя. При нагреве воды на поверхностях нагрева образуются твердые отложения накипеобразующих солей. При испарении воды в пар переходят коррозионно-активные газы, которые способствуют разрушению поверхности охлаждения и генерируют новые вещества, образующие отложения из продуктов коррозии. Надежность работы энергетического оборудования на станции непосредственно связана с качеством подпиточной воды котлов. Правильно рассчитанный, смонтированный и эксплуатируемый комплекс водоподготовки, дополненный химической программой коррекции котловой воды, является необходимым условием долговечной и экономичной работы любого котлоагрегата. В условиях эксплуатации энергетического оборудования на ТЭС или АЭС при организации водного режима необходимо создавать условия, при которых обеспечиваются минимальные значения скорости коррозии и снижение накипных отложений. Отложения могут образовываться из примесей, поступающих в воду теплоэнергетических установок от внешних и от внутренних источников. Исходные данные Исходной водой является вода Бассейны Ингула со следующим химическим составом: -биогенные компоненты:
NO2+=0,030 мг/л; NO3+=0,11 мг/л; Fe=0,11 мг/л; P=0,060мг/л; Si=5,9 мг/л; -окисляемость: БО=28,4 мгО2/л; ПО=7,8мгО2/л; -главные ионы: HCO3-=294,7 мг/л; SO42-=67,8 мг/л; Cl-=55,7 мг/л; Ca2+=92,3 мг/л; Mg2+=15,9 мг/л; Na++K+=38,5мг/л; -Жо=5,9 мг-экв/л; Блоки: 210МВт 6шт. Таблица 1
Расчёт и корректировка исходного состава воды Для начала найдём эквивалентные массы ионов: Э = М/Z, где М- молярная масса иона; Z- заряд иона. Э(Са2+) = 40,08/2 = 20,04 г-экв; Эквиваленты остальных ионов считаются аналогично. Расчет начинаем с анионного состава воды: [С] = [Н]/Э, где [Н]- концентрация иона, выраженная в мг/л, Э- эквивалент иона. С(HCO3-) =3,274мг-экв/кг; С(SO42-) = 0,360мг-экв/кг; C(Cl-) = 0,367 мг-экв/кг. Σ An = 4,001мг-экв/кг. Рассчитаем катионный состав воды: С(Са2+) = 2,585мг-экв/кг; С(Mg2+) = 0,899мг-экв/кг; С(Na+) = 0,278мг-экв/кг; Σ Kt = 3,762мг-экв/кг. Правильность определения концентраций катионов и анионов, т.е. солей, образованных эквивалентным количеством ионов, проверяют на основании закона электронейтральности по уравнению: Σ Kt=ΣAn. При несоблюдении этого условия, следует скорректировать состав воды. Это достигается путём добавления натрия Na+. Т.о. закон электронейтральности соблюдается. Пересчитаем значения концентраций примесей в другие виды концентраций: [N]= [Н]/(М.1000), моль/л; Пересчёт остальных концентраций осуществляется аналогично. [С]= [Н]/104,% Ионная сила раствора равна полусумме произведений молярных концентраций на квадраты их зарядов. μ =
0,5 Коэффициент активности – функция ионной силы раствора: lg f' =
-0.5Zi2 f = 10 Концентрация в природных водах недиссоциированных молекул Н2СО3 составляет обычно лишь доли процента от общего количества свободной углекислоты, под которым понимают сумму Н2СО3+ СО2. Равновесное значение суммы Н2СО3+ СО2, моль/кг Н2СО3+ СО2
= и рН равновесное
Таблица 2
Вывод: Величина pH имеет оптимальное значение, т.к. входит в интервал 5,5-7,5. Бикарбонатная щелочность увеличилась на дозу коагулянта, а содержание сульфатов увеличилось. Коагуляция исходной воды В данном случае, в качестве коагулянта использовался сернокислый алюминий Al2(SO4)3. Доза добавляемого коагулянта: Dk = 0,07.ПО = 0,12.8,1 = 0,972мг-экв/л. Т.к. Dk>0,5 принимаем это значение равное 0,5 мг-экв/л. Оптимальное значение рН при коагуляции с сернокислым алюминием находится в интервале 5,5 7,5. Значение величины рН среды при коагуляции оказывает влияние на скорость и полноту гидролиза. При коагуляции в обрабатываемой воде увеличивается содержание сульфатов, но уменьшается бикарбонатная щелочность на дозу коагулянта. Катионный состав воды не меняется. Таблица 3
Коагуляция с известкованием исходной воды (гидратный режим) Гидратный режим известкования благоприятен для удаления магния, соединений железа, кремния и для осветления воды. Для расчёта данной таблицы использовали коагулянт – сернокислое железо FeSO4 и гашёную известь Са(ОН)2. Оптимальное значение рН находится в интервале 9 – 10,5. Доза коагулянта Dk = 0,5 мг-экв/л. Т.к. воды относятся к III группе и являются щелочными, т.е содержание ионов НСО3- находится в избытке по сравнению с остаточной жесткостью, то известкование в этом случае является нецелесообразным. Воду из III группы переводят в I путем добавления CaCl2 эквивалентно содержанию HCO3-. Доза извести считается следующим образом: Dи = СО2исх + ΔНСО3- + Dk+Ии, мг-экв/л; Приняв значение ОН, определяем остаточную концентрацию иона Mg2+. Mg2+ост = Используя закон электронейтральности, находим остаточную концентрацию ионов Са2+: Концентрация сульфатов увеличивается на дозу коагулянта. Таблица 4
Коагуляция и известкование исходной воды (карбонатный режим) В качестве коагулянта используется сернокислое железо, доза которого Dk = 0,5 мг-экв/л. Доза извести считается следующим образом: Dи = СО2исх + ΔНСО3- + Dk+Ии, мг-экв/л; Приняв значение ОН, определяем остаточную концентрацию иона Mg2+. Mg2+ост = Концентрацию магния не изменяется. Остаточная концентрация кальция рассчитывается из закона электронейтральности (концентрация ионов магния и натрия не изменяется): Карбонатный режим применяют: 1) когда вынужденно приходится использовать в качестве коагулянта сернокислый алюминий; 2) при необходимости исключить выделение магниевых соединений, чтобы в случае соблюдения определённых гидравлических условий получать при известковании крупнокристаллический осадок. При карбонатном режиме несколько уменьшается расход извести (по сравнению с гидратным режимом). Таблица 5
Коагуляция с известкованием и содированием исходной воды Доза извести считается следующим образом: Dи = СО2исх + ΔНСО3- + Dk+Ии, мг-экв/л; Происходящие при известково-содовом умягчении основные химические процессы описываются следующими уравнениями: а2СО3 → 2 Nа+ + СО32-; Са(ОН)2 → Са2+ +2ОН-; СО2 + 2ОН- → СО32- + Н2О; Н+ + ОН- → Н2О НСО3- → Н+ + СО32- НСО3- + ОН- = СО32- + Н2О; Са2+ + СО32- → СаСО3↓; Мg2+ + 2ОН- → Мg(ОН)2↓. Приняв значение ОН- определяем остаточную концентрацию ионов кальция и магния. Концентрация сульфатов увеличивается на дозу коагулянта. Т.о. остаточную концентрацию натрия определяем из закона электронейтральности. Таблица 6
Вывод: Для данных вод с содержанием ГДП>2 мг/л, Ок>4 мгО2/л, Жк>2 мг-экв/л, Жнк<10 мг-экв/л, концентрацией Si<3 мг/л оптимальной схемой предочистки является К+Иг+Ф и К+Иб+Ф. Коагуляция с известкованием и магнезиальным обескремниванием исходной воды Основным из числа методов магнезиального обескремнивания воды является метод обескремнивания каустическим магнезитом. Одновременно с обескремниванием воды проводят её известкование и коагуляцию. Известкование при магнезиальном обескремнивании производится для того, чтобы снизить щёлочность воды и создать должную величину рН. При рН<10удаление кремнекислых соединений будет затруднено из-за недостаточной диссоциации Н2SiО3. Кроме того, вследствие низкой концентрации в воде ионов ОН- обескремнивающий реагент будет взаимодействовать с бикарбонат-ионами исходной воды, свободной угольной кислотой, а также введённым в воду коагулянтом: МgО + Н2О → Мg(ОН)2 → Мg2+ + 2ОН-; ОН- + Н+ → Н2О; НСО3- → СО32- + Н+; СО2 + Н2О → Н2СО3 → Н+ + НСО3- → 2 Н+ + СО32-; СО32- + Са2+ → СаСО3↓; 2 ОН- + Fе2+ → Fе(ОН)2. Экспериментальные данные подтверждают, что обескремнивание наиболее эффективно происходит в узком интервале величин рН=10,1 – 10,3, достигая в отдельных случаях 10,4. Оптимум рН несколько различен для разных вод. Доза извести считается следующим образом: Dи = СО2исх + ΔНСО3- + Dk+Ии, мг-экв/л; При расчёте данной таблицы использовали коагулянт FeSO4, доза которого Dk = 0,5 мг-экв/л, остаточную концентрацию кальция определяем из закона электронейтральности. Таблица 7
Вывод: Количество воды, поступающей в осветлители на обработку известью и другими реагентами составляет Qдвб=446,9 т/ч. Расчет производительности ВПУ Производительность ВПУ по обессоленной воде:
где
r – доля потери пара и конденсата в контуре блока; n=6 - количество энергоблоков на станции;
z – доля потери конденсата в подогревателях воды тепловых сетей; r1 – доля отбора пара на подогрев воды в тепловых сетях;
Количество исходной воды, поступающей в осветлитель, т/ч:
х - доля потери воды с продувкой воды (при обезвоживании шлама и возврате фугата в осветлитель х=0); х1 - доля потери на собственные нужды. Таблица 8
Вывод: оптимальным является режим с минимальной величиной продувки, в данном случае - бикарбонатный режим известкования и известкование с содированием. Оборотные системы охлаждения (ОСО) Расчет потерь воды в ОСО В
результате циркуляции по замкнутому циклу в системе охлаждения часть оборотной
воды выводится из системы вследствие испарения Коэффициент концентрирования не выпадающих в осадок солей:
где к зависит от температуры воздуха, ∆t -
охлаждение воды в градирне, принимается 5-10
ОСО1 Т.к. концентрация НСО3- в исходной воде больше 3 мг-экв/л, расчет не производится, т.к. система является нецелесообразной ОСО2 Для предупреждения выпадения гипса необходимо выдерживать такое неравенство: Ca2+ < Где, CaSO4 = 2,5 10-5 (моль/кг)2. Доза серной кислоты:
Рассчитываем
ОСО3 Добавляем
оксиэдилдифосфоновую (ОЭДФК) и серную кислоты. Проверяем выпадет ли в осадок
(табличное значение),значит не выпадет. Рассчитываем
Доза серной кислоты:
ОСО4 Добавляем
оксиэдилдифосфоновую (ОЭДФК) и серную кислоты. Проверяем выпадет ли в осадок
(табличное значение),значит не выпадет. Добавляем
известь и серную кислоту, проверяем, выпадет ли в осадок
(табличное значение),значит не выпадет. Рассчитываем
Таблица 9
Вывод: т.к.,(|898.2- 250*4|/898.2)*100= 11.34 % выбранные осветлители 250-И подходят по производительности. Поверочный расчет осветлителя Выбор осветлителя: необходимо выбирать не менее двух одинаковых осветлителей (т.к. обязательно нужен резервный на случай выхода из строя одного из осветлителей) и не более трех, т.к. на их обслуживание идут большие экономические затраты. Выбираем 4 осветлителя 250-И. Производительность
осветлителя,
где
где
где Э эквивалент коагулянта, t
температура воды в интервале
где П прозрачность воды по кресту, см: П=300
Приведенная высота зоны контактной среды осветлителя, м:
Выбранный осветлитель 250-И подходит нам по производительности. Выводы: Для данной исходной воды с содержанием ГДП>2 мг/л, Ок>4 мгО2/л, Жк>2 мг-экв/л, Жнк<10 мг-экв/л, концентрацией Si<3 мг/л оптимальным является гидратный режим известкования (стр 31[1]), при котором величина продувки имеет минимальное значение и затраты на реагенты меньшие. Список использованной литературы 1. Кишневский В.А. Современные методы обработки воды в энергетике: Учебное пособие. - Одесса: ОГПУ,1999-196 с. 2. Громогласов А.А., Копылов А.С., Пильщиков А.П. Водоподготовка: Процессы и аппараты: Учеб. пособие для вузов.-М.: Энергоатомиздат,1990-272с. 3. Кульский Л.А., Строкач П.П. Технология очистки природных вод.-Киев: Вища школа. Головное изд-во,1981.-328 с. 4. Стерман Л.С. и др.Тепловые и атомные электростанции: Учебник для вузов.- М.: Энергоиздат,1982.-456 с., ил. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
| 17.06.2012 |
| Большое обновление Большой Научной Библиотеки |
| 12.06.2012 |
| Конкурс в самом разгаре не пропустите Новости |
| 08.06.2012 |
| Мы проводим опрос, а также небольшой конкурс |
| 05.06.2012 |
| Сена дизайна и структуры сайта научной библиотеки |
| 04.06.2012 |
| Переезд на новый хостинг |
| 30.05.2012 |
| Работа над улучшением структуры сайта научной библиотеки |
| 27.05.2012 |
| Работа над новым дизайном сайта библиотеки |


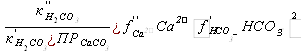 ,
,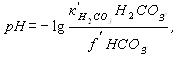
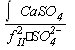 .
. 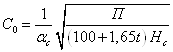 ,
,