|
Курсовая работа: Получение хлора при электролизе хлорида алюминияКурсовая работа: Получение хлора при электролизе хлорида алюминия1. Электролиз хлорида алюминия Комбинирование двух способов позволяет не только перерабатывать боксит с высоким содержанием кремния, но и заменить едкий натр более дешевым карбонатом натрия. Комбинированный способ применяют также для одновременной переработки низко- и высококремнистого боксита, а также с целью исключения процесса каустификации соды, которую можно использовать при спекании. Основной целью переработки нефелинов является отделение Al2O3 от кремнекислоты и щелочи. При переработке нефелинов получают обычно три продукта: глинозем, поташ (или соду) и известково-кремниевые шламы, используемые для производства портланд-цемента. Переработка нефелинов аналогична переработке боксита методом спекания. Предложены и гидрохимические способы переработки нефелинов. Переработка алунитов осуществляется восстановительно-щелочным способом в печах кипящего слоя. Принципиальной особенностью этого способа является обезвоживание и восстановительный обжиг алунитов. При этом в раствор переходят алюминат натрия и сульфаты щелочных металлов: раствор выпаривают, и сульфаты щелочных металлов выпадают в осадок. Раствор алюмината натрия далее перерабатывают по способу Байера. Получение криолита Процесс получения синтетического криолита состоит из стадий термической обработки плавикового шпата серной кислотой в цилиндрических вращающихся печах при 350°С, улавливания печных газов водой, очистки растворов от кремнекислоты и выделения криолита. Основные реакции процессов: CaF2 + H2SO4 → 2HF + CaSO4 (15.з) SiO2 + 6HF →H2SiF6 + 2H2O HF и H2SiF6 газообразные продукты, улавливаемые водой. Для обескремнивания полученного раствора в него вначале вводят расчетное количество соды: H2SiF6 + Na2CO3 → Na2SiF6 + CO2 + H2O (15.и) Труднорастворимый Na2SiF6 отделяют, а оставшийся раствор плавиковой кислоты нейтрализуют избытком соды и гидроксидом алюминия с получением криолита: 12HF + 3Na2CO3 + 2Al(OH)3 → 2(3NaF·AlF3) + 3CO2 + 9H2O (15.к) Таким же путем могут быть раздельно получены NaF и AlF3, если обескремненный раствор плавиковой кислоты нейтрализовать рассчитанным количеством Na2CO3 или Al(OH)3. Электроды и другие материалы С помощью электродов электрический ток подводят к шихте или электролиту. Поэтому электрод должен отличаться хорошей электропроводимостью и химической стойкостью при повышенной температуре, а также высокой чистотой. В большинстве случаев, в частности и при получении алюминия, электрод может и сам участвовать в электрохимических и химических процессах. Различают два типа угольных электродов: прессованные обожженные и самообжигающиеся. Для их изготовления мелкие угольные зерна смешивают с углеродистым связующим (пеком). Полученную пластичную массу прессуют и подвергают длительному обжигу без доступа воздуха при 1300 — 1400°С. Прессование электродов под высоким давлением ведут в формах нужных размеров. Прессованные необожженные электроды называют "зелеными" электродами. При обжиге происходит коксование связующего и отдельные зерна твердого углеродистого материала соединяются в общую массу. Графитовые электроды получают путем дополнительной термической обработки обожженных угольных электродов при высокой температуре. Самообжигающиеся электроды коксуют непосредственно в самом электролизере за счет тепла, выделяющегося при прохождении тока через сырую углеродистую массу, набиваемую в металлический кожух электрода. При этом из массы удаляются летучие вещества. Обожженные прессованные блоки применяют в качестве анодов, как при получении электролитического алюминия, так и в процессе его рафинирования. Электролиз криолит-глиноземного расплава В соответствии с современными данными о структуре расплавленных солей можно считать, что криолит-глиноземные расплавы являются однородными, упорядоченными в ближнем порядке системами из ионов Na+, Al3+, F-, O2-. Процесс разложения глинозема при электролизе с инертными по отношению к кислороду анодами (например, из платины) может быть в общем виде представлен реакцией 2Al2O3 → 4Al + 3O2 (15.л) На практике электролиз криолит-глиноземного расплава проводят на анодах из углеродистых материалов, поэтому конечными анодными продуктами являются не кислород, а СО и СО2. Суммарная реакция разложения глинозема в промышленных электролизерах может быть представлена в виде: 2Al2O3 + 3C → 4Al + 3CO2 (15.м) Al2O3 + 3C → 2Al + 3 CO Значения э.д.с. этих реакций, рассчитанные по термодинамическим данным, равны 1,167 и 1.034 В. Экспериментально найденное значение э.д.с. в алюминиевых электролизерах при плотности тока 10 кА/м2 (1 А/см2) лежит в пределах 1,4 — 1,8 В. Различие между фактической и расчетной э.д.с. отдельные авторы объясняют хемосорбцией кислорода на угольных электродах, который сохраняется и после отключения тока. В криолит-глиноземном расплаве возможно существование различных катионов и анионов, причем каждый из таких ионов может принимать участие в электрохимических или промежуточных химических процессах, протекающих в электролизере. Выход по току при электролизе криолит-глиноземного расплава не достигает 100% и составляет 85 90%. Это объясняется возможностью обратного растворения катодного металла в электролите и образованием соединений одновалентного алюминия, так называемых субсоединений: 2Al + Na3AlF6 → 3AlF + 3NaF Одновалентный алюминий вновь легко окисляется на аноде, что снижает долю тока, расходуемого на обычные анодные процессы. Другими побочными реакциями могут быть разряд ионов Na+ на катоде и дальнейшее его взаимодействие с электролитом с образованием субфторидов натрия (Na2F). Необходимая температура электролита — от 940 до 960°С. При этой температуре электролит как бы "перегрет" на 10 — 30°С по отношению к температуре начала кристаллизации Межэлектродное расстояние в процессе электролиза криолит-глиноземного расплава — весьма важный параметр. Оно определяет не только температуру расплава, но и напряжение на ванне при постоянных силе тока и составе электролита. Для поддержания напряжения 4,2 4,5 В межэлектродное расстояние должно быть в пределах 4 — 5 см. Состав электролита Глинозем и криолит являются основными составляющими электролита при производстве алюминия электролизом. Многочисленные попытки заменить криолит другими расплавленными средами не привели к положительным результатам. Преимущества криолита заключаются в хорошей растворимости в нем глинозема и отсутствии элементов с более положительным потенциалом, чем алюминий, которые, разряжаясь на катоде могли бы загрязнять металл. Криолит-глиноземные расплавы характеризуются достаточной электропроводимостью, сравнительно небольшим давлением насыщенного пара. Плотность электролита меньше плотности расплавленного алюминия, что позволяет применять в качестве катода алюминий, располагаемый под слоем электролита. Все физико-химические свойства электролита существенно зависят от содержания Al2O3, которое изменяется в процессе электролиза. По мере уменьшения содержания Al2O3 растут температура начала кристаллизации, плотность и электропроводность электролита, уменьшается его вязкость. Конструкция и эксплуатация электролизеров Современный электролизер состоит из пяти основных частей: корпуса ванны, катода, анода, катодного токоподвода и анодного токоподвода Корпус ванны изготавливают из стальных листов, футеруют угольными блоками 4 и плитами 6. В работающей ванне образуется корка застывшего электролита — гарниссаж 5, которая предохраняет футеровку от разрушения расплавленным электролитом. Катодом служит расплавленный алюминий, который расположен на дне электролизера в виде слоя высотой 0,1 — 0,2 м. Подвод тока к расплавленному алюминию через угольные блоки 4 осуществляется с помощью стержней 3. Введенные в блоки стальные стержни для улучшения контакта заливают чугуном или утрамбовывают углеродистой массой. В качестве анодов в электролизерах применяются угольные блоки 4. Многоанодные электролизеры на большинстве заводов теперь заменены одноэлектродными, что значительно упростило регулирование работы электролизеров. Аноды подвешивают на железную раму 12 с помощью стальных штырей 16, которые одновременно служат для подвода тока. На углах анодной рамы закреплены тяги, соединенный с подъемным механизмом. С помощью подъемного механизма анод по мере его сгорания можно опускать вниз. В современных электролизных цехах ванны расположены в два или четыре ряда. В связи с применением электролизеров большой мощности предлагают располагать ванны в один ряд в двухэтажном здании. Число последовательно соединенных в серии алюминиевых ванн может достигать 160. С увеличением мощности агрегатов снижаются удельные капитальные вложения, повышается производительность труда, но с увеличением токовой нагрузки возрастает и отрицательное влияние электромагнитных и гидродинамических сил. С повышением мощности ванн удельные капитальные затраты и себестоимость алюминия достигают минимальных значений в интервале 150 — 175 кА при ширине анода в 3 м. В настоящее время свыше 80% цеховых затрат приходится на долю сырья, основных материалов и электроэнергии. Рафинирование алюминия Извлекаемый из электролизных ванн алюминий часто не является конечным продуктом, его называют алюминием-сырцом или черновым алюминием. Он содержит в виде примесей газы (Н2), глинозем, карбид и нитрид алюминия, углерод и некоторые металлы (кремний, железо, медь). В зависимости от чистоты исходных материалов содержание примесей в алюминии составляет 0,15 — 0,50%. Примеси ухудшают механические свойства алюминия и его коррозионную стойкость, а также снижают его электропроводимость. Для очистки от включений натрия и других щелочных и щелочноземельных металлов жидкий алюминий может подвергаться хлорированию. На современных заводах повышение чистоты первичного алюминия достигают посредством продувки газами, вакуумированием, обработкой флюсами. Известно комбинированное рафинирование, в котором совмещена продувка газом, вакуумирование и восстановление. Вакуумирование алюминия в миксере непосредственно перед разливкой считается наиболее надежным способом удаления водорода. Предусмотрен выпуск алюминия различных марок. В процессе электролиза получают алюминий технической чистоты 99,5 — 99,85%. Металл высокой чистоты (99,95 — 99,995% Al) получают путем электролитического рафинирования технического металла, а металл особой чистоты (не менее 99,999% Al) — в результате специальной очистки. Процесс промышленного электролитического рафинирования осуществляется в электролизере, особенностью которого является наличие в нем трех жидких слоев. Нижний слой служит анодом. Он состоит из рафинируемого алюминия, в который с целью его утяжеления добавляют 30 — 40 масс. % меди. При анодной поляризации медь в этих условиях не растворяется. Плотность анодного сплава должна быть выше 3,0·103 кг/м3. Средний слой является расплавленным электролитом (смесь фторидов и хлоридов бария, натрия, алюминия, кальция, магния) с плотностью 2,7·103 кг/м3. Один из возможных составов электролита (в масс. %): 60 BaCl2, 23AlF3, 12 — 17 NaF, до 4% NaCl. Температура плавления такого электролита 720 — 730°С. Третий, верхний, слой представляет собой расплавленный рафинированный алюминий (плотность 2,35·103 кг/м3), который служит катодом. В процессе электролиза такие примеси в рафинируемом металле, как Cu, Fe, Si, Zn, Ti, остаются в анодном сплаве, Na, Ca, Mg переходят в электролит. Выход алюминия по току при рафинировании в промышленных условиях (плотность тока 4,5 — 7,5 кА/м2 (0,45 — 0,75 А/см2)) составляет 95 — 98%. Срок работы электролизера для рафинирования алюминия 4 — 5 лет. Современные промышленные ванны для получения рафинированного алюминия рассчитаны на силу тока 25 — 70 кА. Удельный расход электроэнергии постоянного тока 17370 — 19830 кВт·ч/т. Расход материалов на получение 1 т рафинированного алюминия составляет (в кг): алюминий сырец 1020 — 1030, графит 12 — 17, медь 10 — 16, хлорид бария 27 — 41, криолит 16 23, фторид алюминия 4 — 13. Электролитическое рафинирование алюминия является одним из наиболее энергоемких процессов в металлургии легких металлов, причем 93 — 95% используемой энергии расходуется на поддержание теплового режима электролизера. Важными задачами являются снижение удельного расхода электроэнергии и изыскание новых футеровочных материалов взамен магнезита, обеспечивающих повышение срока службы электролизеров и уменьшение перехода примесей в алюминий. Для производства полупроводниковых материалов требуется алюминий чистотой 99,9999 — 99, 999990% Al, что не достигается при электролитическом рафинировании. Глубокую очистку алюминия осуществляют с помощью зонной плавки или дистилляции через субфторид. Очистка путем зонной плавки основана на различной растворимости примесей в твердом и жидком алюминии. При затвердевании кристаллы алюминия содержат меньше примесей, чем жидкая фаза. Метод дистилляции алюминия основан на взаимодействии алюминия с AlF3 при высокой температуре (1000 — 1050 °С) с образованием летучего монофторида. Парообразный AlF, попадая затем в "холодную" зону (700 — 800 °С), распадается. Для получения металла чистотой 99,999% иногда используют процесс электролитического рафинирования в органических средах. Для обеспечения чистоты 99,9999% проводят дополнительную зонную перекристаллизацию. Первый процесс протекает в электролите, содержащем AlF3·2Al(C2H5)3 и толуол (1:1), при 100°С. Катодная плотность тока 30 А/м2 и напряжение на ваннах 1,0 — 1,5 В, межэлектродное расстояние 3 см, выход по току близок к 100%. Электролиз хлорида алюминия Классический способ получения алюминия электролизом криолит-глиноземных расплавов имеет ряд недостатков, главными из которых являются высокий расход электроэнергии и углеродистых материалов и вредные выделения фторидов. Наиболее перспективным процессом, конкурирующим с классическим способом, может быть электролиз хлорида алюминия. Технологическая схема предусматривает восстановительную электроплавку алюминий содержащего сырья с получением сплава состава (в %): Al — 50, Fe — 30, Si — 10, Ti — 5, C — 5. Далее путем хлорирования сплава при 13000С хлоридом алюминия получают AlCl, из которого диспропорционированием при 700°С выделяют AlCl3 и металлический алюминий. 2. Получение хлора при электролизе хлорида алюминия Получение алюминия путем электролиза хлорида алюминия в расплаве или в присутствии электролита представляет большой интерес и теоретически вполне возможно. Однако этот экономически выгодный процесс никогда не был реализован на практике. Это связано с наличием многих нерешенных практических проблем, например высокой коррозионной активностью электролита, содержащего галогениды щелочных и (или) щелочноземельных металлов, необходимостью использования хлорида алюминия определенной степени чистоты поддержания точной его концентрации в электролизере и других. Для осуществлений этого процесса имеются препятствия как технического так и экономического характера. Одной из многих проблем является переработка и удаление газов, выходящих из электролизера. Эта проблема становится особенно острой в тех случаях, когда в качестве электролита используют галогениды щелочноземельных или щелочных металлов или их смеси, содержащие хлорид алюминия, поскольку при этом выделяющийся газ состоит главным образом из хлорида. Хлор обладает высокой реакционной способностью, является коррозионным агентом и ядовитым веществом. Кроме него в газе содержатся небольшие количества таких компонентов как азот, С03 и следы компонентов расплава, таких как натрийалюминий хлорид, хлорид алюминия и комбинации хлорида алюминия с галогенидами щелочных и (или) щелочноземельных металлов; последние находятся в виде конденсируемого газа.
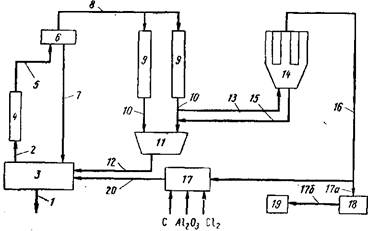
Рис. 1. Схема рециркуляции в обработки отходящих газов процесса электролитического получения алюминия из хлористого алюминия Присутствие этих компонентов в отходящем газе приводит не только к нежелательным потерям компонентов расплава, но и обусловливает высокую коррозионную активность газа, что препятствует его повторному использованию без дополнительной обработки. Кроме того, здесь возникают проблемы, связанные с засорением труб, через которые проходят отходящие газы, например в результате конденсации в них галогенидов щелочных и (или) щелочноземельных металлов или других вышеупомянутых соединений. Переработка отходящих газов связана и с другими проблемами, в частности с трудностями при конденсации таких газов для использования их в химических реакциях или хранения в жидком виде. Алюминий получают в электролизере 3 путем электролиза хлорида алюминия, Растворенного в расплаве хлоридов щелочных или щелочноземельных металлов или их смеси; температура внутри электролизера обычно составляет около 700 °С. При работе электролизера алюминий удаляется в расплавленном виде как показано стрелкой 1, а отходящие газы, состоящие в основном из хлора с малыми количествами азота и хлоридов щелочных и (или) щелочноземельных металлов, а также хлорида алюминия, унесенных из расплава, удаляются из электролизера как показано стрел- Типичный состав отходящих газов, %: С1 91,5 сл., N 1,8, хлоридов щелочных и (или) щелочноземельных металлов 4,8, хлорида алюминия 1,9 сл., кислорода; хлориды щелочных и щелочноземельных металлов находятся в газообразном состоянии и в виде очень мелких частиц, образующих дым. После выделения и удаления из электролизера 3 отходящий газ приведенного состава, находящийся при температуре около 700 °С, охлаждают, обычно пропуская через теплообменник 4, до заданной температуры при которой будет происходить селективная конденсация всех хлоридов щелочных и щелочноземельных металлов, не сопровождающаяся конденсацией или десублимацией хлорида алюминия. В теплообменнике температура отходящего газа снижается примерно до 150— 200 °С, в результате происходящей конденсации образуются маленькие капли жидкости или туман. Охлажденные отходящие газы по линии 5 подаются в зону коалесценции, которая на схеме представлена противозапотевающим устройством 6. В нем происходит коалесценция сконденсировавшихся капель хлоридов щелочных и щелочноземельных металлов, а также части хлорида алюминия; жидкая фаза отделяется от отходящего газа. Коалесцированная жидкая фаза, обычно содержащая 0, 16 — 3,3 г/л растворенного хлорида алюминия при стандартных условиях (0,1 МПа, 25 °С), по линии 22 возвращается непосредственно в электролизер 3 для возмещения потерь компонентов расплава. Обедненные отходящие газы, содержащие 0,06 г/л. газообразного хлорида алюминия, по линии 8 подаются в зону конденсации с конденсатором 9, который может представлять собой трубчатый теплообменник или псевдоожиженный слой хлорида алюминия, работающий при более низких температурах, которые часто ниже 100 °С. При этом происходит десублимация остаточного хлорида алюминия и его предвари-тельное отделение, после чего он по линии 10 направляется в сборник 11, где собирается в кристаллическом виде. Полученный таким образом хлорид алюминия по линии 12 может быть снова подан на электролиз в тот же самый или в другой электролизер. Оставшиеся относительно чистые отходящие газы по линии 13 направляют в мешочные фильтры или в фильтровальные узлы, в которых происходит улавливание всех оставшихся твердых примесей, в особенности имеющих малые размеры. Твердая фаза, отделенная в мешочных фильтрах 14, состоит главным образом из хлорида алюминия. Если он имеет достаточную чистоту, то по линии 15 он может быть подан в сборник //, а оттуда в случае необходимости возвращен в электролизер 3. Отходящие газы после фильтра 14 содержат относительно чистый газообразный хлор и некоторые количества азота; по линии 16 их направляют к месту утилизации. Такой газообразный хлор, возможно содержащий другие хлористые соединения, может быть направлен в зону получения хлорида алюминия 17, где он реагирует с алюминийсодержащим материалом в присутствии восстановителя, например угля. По меньшей мере часть хлора и углерода в этой реакции может быть в связанном состоянии например в виде четыреххлористого углерода или карбонилхлорида. В другом варианте газообразный хлор по линии 17а можно направить в конденсатор 18 и полученный жидкий хлор по линии 17 транспортировать к месту хранения 19. Наличие линии 20, позволяет использовать хлорид алюминия, полученный в зоне 17, в том же самом или в другом электролизере 3. 3. Исследование и разработка безотходной технологии утилизации алюминийфторуглеродсеросодержащих отходов алюминиевого производства При производстве алюминия электролизом растворенного глинозёма в расплаве фтористых солей при температуре =960°С происходит хроническое образование высокотоксичных алюминийфторуглеродсеросодержащих отходов — отработанной угольной футеровки электролизёров и тонкодисперсного шлама с содержанием углерода 25-70%, фтора 6-16%, алюминия 4-10%, натрия 6-19%, серы 0,1-1,3%, цианидов до 1% и других компонентов [1. 2.]. Наибольшую опасность в твердых отходах представляют водорастворимые фториды, например, NaF и цианиды. Известно несколько разработанных способов утилизации рассматриваемых отходов. Однако до промышленной реализации доведены лишь некоторые из них, по которым не полностью утилизируется отработанная футеровка из-за низкой эффективности или по экономическим соображениям [1-5]. Алюминийфторуглеродсеросодержащие шламы в настоящее время не перерабатываются и в значительных количествах хранятся на полигонах, загрязняя окружающую среду. По самым скромным оценкам, в мире накопилось несколько десятков миллионов тонн таких отходов, которые можно отнести к техногеннымм видам металлургического сырья. Рассматриваемые отходы содержат в своем составе ценные компоненты, при переработке которых можно получить существенный экономический и экологический эффект. Для эффективной утилизации отходов необходимо исследовать и разработать безотходную технологию, наносящую минимальный экологический ущерб окружающей среде, имеющую низкие капитальные затраты на ее реализацию и позволяющую получать прибыль. Этому посвящена данная работа. В исследованиях в качестве отходов использовали алюминийфторуглеродсеросодержащий шлам Красноярского алюминиевого завода (ОАО "РУСАЛ Красноярск"), отобранный со шламового поля с влажностью 30% и высушенный при температуре 100°С. Шлам представляет собой механическую смесь пыли электрофильтров, шлама "мокрой" ступени газоочистки, хвостов флотации угольной пены и содержит, % масс. 8,15А1; 0,15 Si; 0,97 Fe; 0,01 Ti; 0,76 Са; 0,27 Mg; 6,46 Na; 1,06 К; 7,085 R (R = Na+K в пересчете на Na); 1,25 S; 10,31 F; 51,6 C; 58,11 п.п.п. (потери при прокаливании). По крупности шлам имеет частицы размером менее 0,05 мм 74,19% и более 0,2 мм 4,37%. Для разработки технологии переработки алюминийфторуглеродсеросодержащих отходов алюминиевого производства и их обезвреживания представляет интерес исследовать поведение при нагреве содержащихся в них фторидов в смеси с СаС03 и Na2C03 и углерода, предполагая, что при этом углерод будет сгорать в воздухе, а фториды прореагируют по следующим химическим реакциям: 2NaF + СаСОз = CaF2 + Na2C03; (1) 2Na3AlF6 + бСаСОз = Na20-Al203 + 6CaF2 + 2Na2C03 + 4C02T; (2) 2A1F3 + 3CaC03 = 3CaF2 + A1203 + 3C02;(3) 2A1F3 + 4Na2C03 = Na20-Al203 + 6NaF + 4C02; (4) CaF2 + Na2C03 = 2NaF + CaO + C02T; (5) CaF2 + Na2C03 = 2NaF + CaC03. (6) С этой целью были приготовлены согласно стехиометрическим коэффициентам в вышеприведенных реакциях следующие смеси веществ марки ч.д.а. крупностью менее 0,08 мм: 2NaF + СаСОз (1), 2Na3AlF6 + 6СаС03 (2), 2A1F3 + ЗСаСО3 (3), 2A1F3 + 4Na2C03 (4), CaF2 + Na2C03 (5). Указанные смеси и используемый в исследованиях алюминийфтроруглеродсеросодержащий шлам проанализированы дифференциально-термическим (ДТА) и термогравиметрическим (TG) методами.
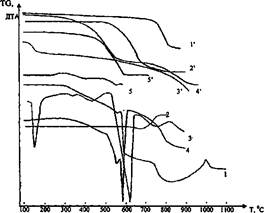
Рис. 1. Термогравиметрический анализ смесей фторидов с известняком и содой. 1, 1' - смесь NaF + СаС03; 2, 2' - смесь A1F3 + СаС03; 3, 3' - смесь Na2C03 + CaF2; 4, 4' - смесь Na3AlF6 + CaC03; 5, 5' - смесь A1F3 + Na2C03. 1, 2, 3, 4, 5 - кривые ДТА; Г, 2', 3', 4', 5' - кривые TG Проведенные исследования подтвердили предположение, что фториды разлагаются известняком и содой при температуре 600-650°С по вышеприведенным реакциям (1-6). По кривым 1, Г видно, что реакция 1 начинается при температуре 420°С, но идет очень медленно. С повышением температуры скорость ее увеличивается, достигая максимума при 530-590°С, и при 600°С она практически заканчивается полным переходом растворимого в воде NaF в нерастворимый CaF2, о чем свидетельствует большой эндотермический эффект на кривой ДТА. При нагревании смеси 2NaF + СаС03 до температуры 620°С практически не наблюдается убыль веса (кривая Г). Это указывает на то, что протекает обменная химическая реакция взаимодействия NaF и СаС03 с образованием CaF2 и Na2C03. Однако при температуре более 620°С образовавшиеся CaF2 и Na2C03, по-видимому, взаимодействуют между собой с образованием снова NaF по реакциям 5 и 6, о чем свидетельствует изменение угла наклона кривой ДТА (кривая 1). Причем до температуры 750°С преимущественно протекает реакция 6, так как на кривой TG (1') отмечается небольшая убыль веса, а при температуре более 750°С в основном идет реакция 6 с образованием, кроме NaF, СаО и улетающего в атмосферу углекислого газа, что резко увеличивает убыль веса (кривая Г). Реакция 2 между криолитом и известняком начинается при температуре 320°С и заканчивается при температуре 620°С с полным переходом алюминия в алюминат натрия. Образовавшиеся при этом CaF2 и Na2C03 реагируют также между собой при температуре более 620°С по реакциям 5 и 6 (кривые 2 и 2'). Реакция 3 между фторидом алюминия и известняком начинается при температуре 540°С, идет активно и при 710-730°С заканчивается полностью (кривые 3 и 3'). Фторид алюминия начинает реагировать с содой по реакции 4 при температуре 490°С, а с известняком — по реакции 3 при температуре 540°С, и заканчивается реакция 4 при температуре 590-600°С, что видно из кривых ДТА и TG (кривые 4 и 4'). Поэтому следует ожидать, что сода, образовавшаяся по реакциям 1, 2 прореагирует с A1F3 с образованием алюмината натрия, а не оксида алюминия по реакции 3. На кривой ДТА шлама (кривая 6) в области температур 350-915 °С наблюдается большой экзотермический эффект с максимумом при 620"С, относящийся, по-видимому, к горению углеродистой массы, которому соответствует убыль массы образца (кривая 6'). Видно, что углерод в шламе горит в широком температурном интервале, что свидетельствует о присутствии в шламе различных его модификаций. Нами установлено, что теплотворная способность углеродистого шлама составляет 12544,8-14635,6 кДж/кг (3000-3500 ккал/кг). Предварительно расчетом было установлено, что молярные отношения в шламе R:A1 = R2O: AI2O3 = 1,02 ед., т.е. для образования алюмината натрия (Na2O.Al2O3) в спеке вводить дополнительно щелочь в шихту для спекания не следует. Поэтому исследования проводили по спеканию шлама только с известняком. В отходах алюминиевого производства содержатся, как было отмечено выше, от 0,1 до 1,3% серы в виде, главным образом, растворимых сульфатов щелочных металлов (Na2S04 и K2SO4), которые при спекании не взаимодействуют с глинозёмом и не образуют алюмината, т.е. являются инертными по отношению к глинозёму [6]. Поэтому важно при спекании серу перевести в нерастворимую форму — CaSO4, а сульфаты натрия и калия в активную форму — карбонаты по химическим реакциям: (Na,K)2S04 + 2С + СаСОз = (Na,K)2C03 + CaS + 2C02; (7) CaS+ 2O2 = CaS04. (8) При выщелачивании спека сера уходит в осадок в виде CaS04. Из стехнометрических коэффициентов реакций 7, 8 видно, что для образования в спеке CaS04 и CaS в шихте должно быть молярное отношение Са: S = 1,0. Поэтому в шихтах для спекания шлама нами выдерживалось это отношение. Образующиеся по реакции 7, 8 карбонаты щелочных металлов взаимодействуют с AIF3 по реакции 4, образуя в спеке легкорастворимые алюминаты — (Na,K)20- AI2O3. Без добавки в шихты известняка для связывания серы в CaS04 щелочь в составе сульфатов не образует алюминатов и снижает извлечение глинозёма из спека (отходов). Для исследования влияния режимов спекания и состава шихты на качество получаемого спека нами были рассчитаны и приготовлены шихты, состоящие из алюминийфторуглерод-серусодержащего шлама ОАО "РУСАЛ Красноярск" и известняка марки ч.д.а. с различными молярными отношениями Ca:F2(oт 0,86 ед. до 1,10 ед.) и постоянными Ca:S = 1,0 ед., R:A1 = 1,02 ед. Характеристика шихт приведена в табл. 1. Методика опытов заключалась в следующем. Предварительно высушенные при температуре 100°С и измельченные до крупности -0,08 мм материалы шихты тщательно перемешивали и спекали, при температурах 550-800"С. Приготовленные шихты помещали на огнеупорных пластинках слоем 1,0-1,5 см. Подъем температуры до заданной осуществляли со скоростью 15-20°С/мин., затем следовала выдержка в течение 1 часа. Спеки охлаждали вместе с печью до 200°С, а далее до комнатной температуры на воздухе. Затем спеки измельчали до крупности -0,08 мм и выщелачивали по стандартной методике содощелочным раствором, содержащим 5,7 г/дм3 Na2Oк (каустической) и 8,4 г/дм3 Na2Oу (углекислой), при отношении жидкого к твердому 20, температуре 70 °С в течение 7 мин. Таблица 1 Характеристика исследуемых шихт из алюминийфторуглеродсеросодержащих отходов и известняка
Таблица 2 Показатели спекания шихт при различных температурах
Показатели спекания исследуемых шихт приведены в табл. 2, из которой видно, что оптимальными режимами для спекания являются температура 600-650°С и молярные отношения в шихте Ca:F2 = 1,04; Ca:S = 1,0; R:A1 = 1,02. При этих режимах достигается максимальное извлечение глинозёма и щелочей из спека в раствор, равное соответственно 77,40-80,67% и 97,30-97,90%. Снижение температуры спекания менее 600°С нецелесообразно, так как приводит к неполному выгоранию углерода из отходов, неполному протеканию вышеуказанных химических реакций, результатом которых является образование в спеке легкорастворимых алюминатов щелочных металлов и нерастворимого фторида кальция (CaF2). Все это ухудшает качество спека, снижает эффективность переработки и обезвреживания экологически опасных алюми-нийфторуглеродсеросодержащих отходов алюминиевого производства. Увеличение температуры спекания более 650°С также нежелательно, так как при этом развиваются вторичные реакции 5, 6, приводящие к переходу в спеке нерастворимого CaF2 в растворимый NaF и, за счет этого, к уменьшению извлечения глинозёма из спеков, снижению эффективности переработки отходов и образованию водорастворимого фтора. При уменьшении молярного отношения в шихте Ca:F2 ниже 1,04 ед. для полного разложения фторидов по реакциям 1-4, образования алюминатов щелочных металлов и связывания фтора в нерастворимый CaF2 при спекании известняка недостаточно. Это обуславливает снижение качества спека и эффективности переработки отходов, ухудшение экологии. Увеличение молярного отношения Ca:F2 более 1,04 приводит к повышению удельных расходных коэффициентов на 1 тонну перерабатываемых отходов (по известняку, шихте, спеку) без улучшения качества получаемого спека и снижению эффективности переработки отходов. Следует отметить, что спекание алюминийфторуглеродсеросодержащих отходов с известняком при температуре 600-650°С позволяет извлечь алюминий, присутствующий в отходах в составе криолита (Na3AJFg) или AIF3, но не позволяет извлечь металлический алюминий и оксид алюминия из отходов, так как для их полного извлечения необходима температура спекания более 1150°С [6]. Учитывая, что количество последних в отходах незначительно, то этими потерями можно пренебречь. Кроме того, при выщелачивании спеков из алюминийфторуглеродсеросодержащих отходов алюминиевого производства получаются флюоритовые шламы, содержащие, % масс: 9-1 А1203, 54-55 СаО; 31-32 F; 0,5-0,6 R20; 0,5-0,6 Si02; 3-4 Fe203; 0,5-0,6 MgO; 0,2-0,3 SO3; 6-8 п.п.п., пригодные для производства фтористых солей, т.е. являющиеся товарным продуктом, которые можно реализовать в качестве флюоритового сырья на предприятия по производству фтористых солей. Результаты проведенных исследований позволили предложить способ переработки техногенного алюминийсодержащего сырья, включающий приготовление шихты из алюминийф-торуглеродсеросодержащих отходов алюминиевого производства и известняка с молярными отношениями Ca:F2 = 0,8-1,2, Ca:S = 1,0 , спекание при температуре 550-800°С и выщелачивание полученного спека, на который получено положительное решение о выдаче патента. Этот способ позволяет эффективно переработать и утилизировать до настоящего времени широко не используемых экологически опасных алюминийфторуглеродсеросодержащих отходов алюминиевого производства. При этом упрощается аппаратурно-технологическая схема спекания, снижается температура спекания, повышается качество спека за счет увеличения его пористости и связывания алюминия в нем в легкорастворимые алюминаты щелочных металлов, практически устраняется расход топлива на спекание за счет сгорания углерода отходов (топливо необходимо лишь при розжиге печи), эффективно обезвреживаются отходы алюминиевого производства, а именно детоксифицируются цианиды и связываются растворимый фтор в нерастворимый фторид кальция. Результаты проведенных исследований с учетом промышленной практики позволили разработать безотходную технологию переработки и утилизации алюминийфторуглерод-серосодержащих отходов алюминиевого производства с получением следующих товарных продуктов: гидроксида алюминия или глинозёма, содопродуктов и флюоритового шлама, пригодного для производства фтористых солей [7] Литература 1. Экологические аспекты производства алюминия электролизом Аналитический обзор / А.Г. Акшиц, П.В. Поляков, А.В. Кучеренко, В.А. Крюковский, Л.А. Сафарова. — Новосибирск: Изд. ГПНТБ СО АН СССР, 1991. - 92 с. 2. Истомин С.П. Проблемы использования фторсодержащих отходов криолитовых и алюминиевых заводов // Цветные металлы, 2002. — №1. — с. 63-67. 3. Петров С.И., Утков В.А., Тесля В.Г. Переработка углеродфторсодержащих отходов производства алюминия // Материалы межвузовской конференции "Металлургия легких металлов на рубеже веков. Состояние и стратегия развития". Санкт-Петербург, 2001. — с. 100. 4. Переработка и повторное использование отработанной подины: Практика использования в Китае // Light Metals, 1994. - с. 269-273. 5. Современные способы переработки, обезвреживания и утилизации отработанной футеровки алюминиевых электролизёров. НТЦ "Сибирский алюминий". Санкт-Петербург, 1999. - 21 с. 6. Лайнер А.И., Еремин Pi.И., Лайнер Ю.А., Певзнер И.З. Производства глинозёма. - М.: Металлургия, 1978. — 344 с. 7. Беляев А.И. Металлургия легких металлов. — М.: Металлургия, 1970 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
| 17.06.2012 |
| Большое обновление Большой Научной Библиотеки |
| 12.06.2012 |
| Конкурс в самом разгаре не пропустите Новости |
| 08.06.2012 |
| Мы проводим опрос, а также небольшой конкурс |
| 05.06.2012 |
| Сена дизайна и структуры сайта научной библиотеки |
| 04.06.2012 |
| Переезд на новый хостинг |
| 30.05.2012 |
| Работа над улучшением структуры сайта научной библиотеки |
| 27.05.2012 |
| Работа над новым дизайном сайта библиотеки |