|
Реферат: Серная кислотаРеферат: Серная кислота
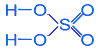
Чистая 100 %-ная серная кислота (моногидрат) представляет собой бесцветную маслянистую жидкость, застывающую в кристаллическую массу при +10 °С. Реактивная серная кислота имеет обычно плотность 1,84 г/см3 и содержит около 95 % H2SO4. Затвердевает она лишь ниже -20 °С. Температура плавления моногидрата равна 10,37 °С при теплоте плавления 10,5 кДж/моль. В обычных условиях он представляет собой очень вязкую жидкость с весьма высоким значением диэлектрической проницаемости (e = 100 при 25 °С). Незначительная собственная электролитическая диссоциация моногидрата протекает параллельно по двум направлениям: [Н3SO4+]·[НSO4-] = 2·10-4 и [Н3О+]·[НS2О7-] = 4·10-5. Его молекулярно-ионный состав может быть приближенно охарактеризован следующими данными (в %): H2SO4 HSO4- H3SO4+ H3O+ HS2O7- H2S2O7 99,5 0,18 0,14 0,09 0,05 0,04 При добавлении даже малых количеств воды преобладающей становится диссоциация по схеме:Н2О + Н2SО4 <==> Н3О+ + НSO4- Химические свойства. H2SO4 - сильная двухосновная кислота. H2SO4 <--> H+ + HSO4- <--> 2H+ + SO42- Первая ступень (для средних концентраций) приводит к 100%-ой диссоциации: K2 = ([H+] · [SO42-]) / [HSO4-] = 1,2 · 10-2 1) Взаимодействие с металлами: a) разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее водорода: Zn0 + H2+1SO4(разб) --> Zn+2SO4 + H2O b) концентрированная H2+6SO4 - сильный окислитель; при взаимодействии с металлами (кроме Au, Pt) может восстанавливаться до S+4O2, S0 или H2S-2 (без нагревания не реагируют также Fe, Al, Cr - пассивируются): 2Ag0 + 2H2+6SO4 --> Ag2+1SO4 + S+4O2 + 2H2O 8Na0 + 5H2+6SO4 --> 4Na2+1SO4 + H2S-2 + 4H2O 2) концентрированная H2S+6O4 реагирует при нагревании с некоторыми неметаллами за счет своих сильных окислительных свойств, превращаясь в соединения серы более низкой степени окисления, (например, S+4O2): С0 + 2H2S+6O4(конц) --> C+4O2 + 2S+4O2 + 2H2O S0 + 2H2S+6O4(конц) --> 3S+4O2 + 2H2O 2P0 + 5H2S+6O4(конц) --> 5S+4O2 + 2H3P+5O4 + 2H2O 3) с основными оксидами: CuO + H2SO4 --> CuSO4 + H2O CuO + 2H+ --> Cu2+ + H2O 4) с гидроксидами: H2SO4 + 2NaOH --> Na2SO4 + 2H2O H+ + OH- --> H2O H2SO4 + Cu(OH)2 --> CuSO4 + 2H2O 2H+ + Cu(OH)2 --> Cu2+ + 2H2O 5) обменные реакции с солями: BaCl2 + H2SO4 --> BaSO4 + 2HCl Ba2+ + SO42- --> BaSO4 Образование белого осадка BaSO4 (нерастворимого в кислотах) используется для идентификации серной кислоты и растворимых сульфатов. MgCO3 + H2SO4 --> MgSO4 + H2O + CO2 H2CO3 Моногидрат (чистая, 100%-ая серная кислота) является ионизирующим растворителем, имеющим кислотный характер. В нём хорошо растворяются сульфаты многих металлов (переходя при этом в бисульфаты), тогда как соли других кислот растворяются, как правило, лишь при возможности их сольволиза (с переводом в бисульфаты). Азотная кислота ведет себя в моногидрате как слабое основаниеHNO3 + 2 H2SO4 <==> H3O+ + NO2+ + 2 HSO4-хлорная - как очень слабая кислотаH2SO4 + HClO4 = H3SO4+ + ClO4- Фторсульфоновая и хлорсульфоновая оказываются кислотами несколько более сильными (HSO3F > HSO3Cl > HClO4). Моногидрат хорошо растворяет многие органические вещества, имеющие в своём составе атомы с неподелёнными электронными парами (способными к присоединению протона). Некоторые из них могут быть затем выделены обратно в неизменённом состоянии путем простого разбавления раствора водой. Моногидрат обладает высоким значением криоскопической константы (6,12°) и им иногда пользуются как средой для определения молекулярных весов. Концентрированная H2SO4 является довольно сильным окислителем, особенно при нагревании (восстанавливается обычно до SO2). Например, она окисляет HI и частично HВr (но не HСl) до свободных галогенов. Окисляются ею и многие металлы - Cu, Hg и др. (тогда как золото и платина по отношению к H2SO4 устойчивы). Так взаимодействие с медью идёт по уравнению: Cu + 2 H2SO4 = CuSO4 + SO2 + H2O Действуя в качестве окислителя, серная кислота обычно восстанавливается до SO2. Однако наиболее сильными восстановителями она может быть восстановлена до S и даже H2S. С сероводородом концентрированная серная кислота реагирует по уравнению: H2SO4 + H2S = 2H2O + SO2 + S Следует отметить, что она частично восстанавливается также газообразным водородом и поэтому не может применяться для его осушки.
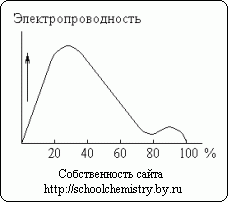
Рис. 13. Электропроводность растворов серной кислоты. Растворение концентрированной серной кислоты в воде сопровождается значительным выделением тепла (и некоторым уменьшением общего объёма системы). Моногидрат почти не проводит электрического тока. Напротив, водные растворы серной кислоты являются хорошими проводниками. Как видно на рис. 13, максимальной электропроводностью обладает приблизительно 30 %-ная кислота. Минимум кривой соответствует гидрату состава H2SO4·H2O. Выделение тепла при растворении моногидрата в воде составляет (в зависимости от конечной концентрации раствора) до 84 кДж/моль H2SO4. Напротив, смешиванием 66 %-ной серной кислоты, предварительно охлажденной до 0 °С, со снегом (1:1 по массе) может быть достигнуто понижение температуры, до -37 °С. Изменение плотности водных растворов H2SO4 с её концентрацией (вес. %) дано ниже:
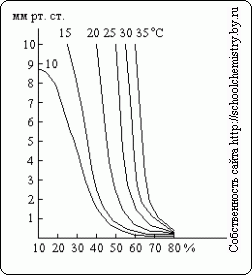
Как видно из этих данных, определение по плотности концентрации серной кислоты выше 90 вес. % становится весьма неточным. Давление водяного пара над растворами H2SO4 различной концентрации при разных температурах показано на рис. 15. В качестве осушителя серная кислота может действовать лишь до тех пор, пока давление водяного пара над её раствором меньше, чем его парциальное давление в осушаемом газе.
Рис. 15. Давление водяного пара.
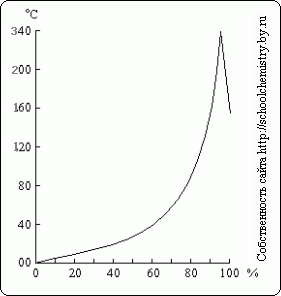
Рис. 16. Температуры кипения над растворами H2SO4. растворов H2SO4. При кипячении разбавленного раствора серной кислоты из него отгоняется вода, причём температура кипения повышается вплоть до 337 °С, когда начинает перегоняться 98,3 % H2SO4(рис. 16). Напротив, из более концентрированных растворов улетучивается избыток серного ангидрида. Пар кипящей при 337 °С серной кислоты частично диссоциирован на H2O и SO3, которые вновь соединяются при охлаждении. Высокая температура кипения серной кислоты позволяет использовать её для выделения при нагревании легколетучих кислот из их солей (например, HCl из NaCl). Получение. Моногидрат может быть получен кристаллизацией концентрированной серной кислоты при -10 °С. Производство серной кислоты. 1-я стадия. Печь для обжига колчедана. 4FeS2 + 11O2 --> 2Fe2O3 + 8SO2 + Q Процесс гетерогенный: 1) измельчение железного колчедана (пирита) 2) метод "кипящего слоя" 3) 800°С; отвод лишнего тепла 4) увеличение концентрации кислорода в воздухе 2-я стадия. После очистки, осушки и теплообмена сернистый газ поступает в контактный аппарат, где окисляется в серный ангидрид (450°С - 500°С; катализатор V2O5): 2SO2 + O2 <--> 2SO3 3-я стадия. Поглотительная башня: nSO3 + H2SO4(конц) --> (H2SO4 · nSO3)(олеум) Воду использовать нельзя из-за образования тумана. Применяют керамические насадки и принцип противотока. Применение. Помните! Серную кислоту нужно вливать малыми порциями в воду, а не на оборот. Иначе может произойти бурная химическая реакция, в результате которой человек может получить сильные ожоги. Серная кислота — один из основных продуктов химической промышленности. Идет на производство минеральных удобрений (суперфосфат, сульфат аммония), различных кислот и солей, лекарственных и моющих средств, красителей, искусственных волокон, взрывчатых веществ. Применяется в металлургии (разложение руд, напр. урановых), для очистки нефтепродуктов, как осушитель и др. Практически важно то обстоятельство, что очень крепкая (выше 75 %) серная кислота не действует на железо. Это позволяет хранить и перевозить её в стальных цистернах. Напротив, разбавленная H2SO4 легко растворяет железо с выделением водорода. Окислительные свойства для неё вовсе не характерны. Крепкая серная кислота энергично поглощает влагу и поэтому часто применяется для осушки газов. От многих органических веществ, содержащих в своём составе водород и кислород, она отнимает воду, что нередко используется в технике. С этим же (а также с окислительными свойствами крепкой H2SO4) связано её разрушающее действие на растительные и животные ткани. Случайно попавшую при работе на кожу или платье серную кислоту следует тотчас же смыть большим количеством воды, затем смочить пострадавшее место разбавленным раствором аммиака и вновь промыть водой. Молекулы чистой серной кислоты.
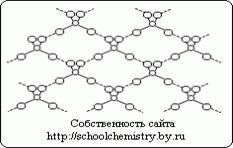
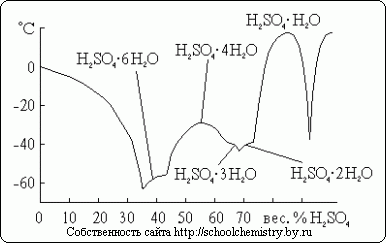
Рис.1. Схема водородных связей в кристалле H2SO4. Молекулы, образующие кристалл моногидрата, (НО)2SO2 соединены друг с другом довольно сильными (25 кДж/моль) водородными связями, как это схематически показано на рис. 1. Сама молекула (НО)2SO2 имеет структуру искаженного тетраэдра с атомом серы около центра и характеризуется следующими параметрами: (d(S-ОН) = 154 пм, РНО-S-ОН = 104°, d(S=O) = 143 пм, РOSO = 119°. В ионе HOSO3-, d(S-ОН) = 161 и d(SO) = 145 пм, а при переходе к иону SO42- тетраэдр приобретает правильную форму и параметры выравниваются [d(SO) = 148 пм].Кристаллогидраты серной кислоты. Для серной кислоты известно несколько кристаллогидратов, состав которых показан на рис. 14. Из них наиболее бедный водой представляет собой соль оксония: H3O+HSO4-. Так как рассматриваемая система очень склонна к переохлаждению, фактически наблюдаемые в ней температуры замерзания лежат гораздо ниже температур плавления.
Рис. 14. Температуры плавления в системе H2O·H2SO4. Список литературы Для подготовки данной работы были использованы материалы с сайта http://schoolchemistry.by.ru/ |
|
|
| 17.06.2012 |
| Большое обновление Большой Научной Библиотеки |
| 12.06.2012 |
| Конкурс в самом разгаре не пропустите Новости |
| 08.06.2012 |
| Мы проводим опрос, а также небольшой конкурс |
| 05.06.2012 |
| Сена дизайна и структуры сайта научной библиотеки |
| 04.06.2012 |
| Переезд на новый хостинг |
| 30.05.2012 |
| Работа над улучшением структуры сайта научной библиотеки |
| 27.05.2012 |
| Работа над новым дизайном сайта библиотеки |


 Физические свойства.
Физические свойства.