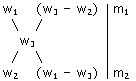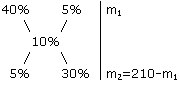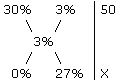|
Реферат: Теория электролитической диссоциацииРеферат: Теория электролитической диссоциацииКонцентрация растворов. Способы выражения концентрации растворов. Существуют различные способы выражения состава раствора. Наиболее часто используют массовую долю растворённого вещества, молярную и нормальную концентрацию. Массовая доля растворённого вещества w(B) - это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m : w(B)= m(B) / m Массовую долю растворённого вещества w(B) обычно выражают в долях единицы или в процентах. Например, массовая доля растворённого вещества - CaCl2 в воде равна 0,06 или 6%. Это означает,что в растворе хлорида кальция массой 100 г содержится хлорид кальция массой 6 г и вода массой 94 г. Пример. Сколько грамм сульфата натрия и воды нужно для приготовления 300 г 5% раствора? Решение. m(Na2SO4) = w(Na2SO4) / 100 = (5 • 300) / 100 = 15 г где w(Na2SO4) - массовая доля в %, m - масса раствора в г m(H2O) = 300 г - 15 г = 285 г. Таким образом, для приготовления 300 г 5% раствора сульфата натрия надо взять 15 г Na2SO4 и 285 г воды. Молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора. C(B) = n(B) / V = m(B) / (M(B) • V), где М(B) - молярная масса растворенного вещества г/моль. Молярная концентрация измеряется в моль/л и обозначается "M". Например, 2 M NaOH - двухмолярный раствор гидроксида натрия. Один литр такого раствора содержит 2 моль вещества или 80 г (M(NaOH) = 40 г/моль). Пример. Какую массу хромата калия K2CrO4 нужно взять для приготовления 1,2 л 0,1 М раствора? Решение. M(K2CrO4) = C(K2CrO4) • V • M(K2CrO4) = 0,1 моль/л • 1,2 л • 194 г/моль » 23,3 г. Таким образом, для приготовления 1,2 л 0,1 М раствора нужно взять 23,3 гK2CrO4 и растворить в воде, а объём довести до 1,2 литра. Концентрацию раствора можно выразить количеством молей растворённого вещества в 1000 г растворителя. Такое выражение концентрации называют молярностью раствора. Нормальность раствора обозначает число грамм-эквивалентов данного вещества в одном литре раствора или число миллиграмм-эквивалентов в одном миллилитре раствора. Грамм - эквивалентом вещества называется количество граммов вещества, численно равное его эквиваленту. Для сложных веществ - это количество вещества, соответствующее прямо или косвенно при химических превращениях 1 грамму водорода или 8 граммам кислорода. Эоснования = Моснования / число замещаемых в реакции гидроксильных групп Экислоты = Мкислоты / число замещаемых в реакции атомов водорода Эсоли = Мсоли / произведение числа катионов на его заряд Пример. Вычислите значение грамм-эквивалента (г-экв.) серной кислоты, гидроксида кальция и сульфата алюминия. Э H2SO4 = М H2SO4 / 2 = 98 / 2 = 49 г Э Ca(OH)2 = М Ca(OH)2 / 2 = 74 / 2 = 37 г Э Al2(SO4)3 = М Al2(SO4)3 / (2 • 3) = 342 / 2= 57 г Величины нормальности обозначают буквой "Н". Например, децинормальный раствор серной кислоты обозначают "0,1 Н раствор H2SO4". Так как нормальность может быть определена только для данной реакции, то в разных реакциях величина нормальности одного и того же раствора может оказаться неодинаковой. Так, одномолярный раствор H2SO4 будет однонормальным, когда он предназначается для реакции со щёлочью с образованием гидросульфата NaHSO4, и двухнормальным в реакции с образованием Na2SO4. Пример. Рассчитайте молярность и нормальность 70%-ного раствора H2SO4 (r = 1,615 г/мл). Решение. Для вычисления молярности и нормальности надо знать число граммов H2SO4 в 1 л раствора. 70% -ный раствор H2SO4 содержит 70 г H2SO4 в 100 г раствора. Это весовое количество раствора занимает объём V = 100 / 1,615 = 61,92 мл Следовательно, в 1 л раствора содержится 70 • 1000 / 61,92 = 1130,49 г H2SO4 Отсюда молярность данного раствора равна: 1130,49 / М (H2SO4) =1130,49 / 98 =11,53 M Нормальность этого раствора (считая, что кислота используется в реакции в качестве двухосновной) равна 1130,49 / 49 =23,06 H Пересчет концентраций растворов из одних единиц в другие. При пересчете процентной концентрации в молярную и наоборот, необходимо помнить, что процентная концентрация рассчитывается на определенную массу раствора, а молярная и нормальная - на объем, поэтому для пересчета необходимо знать плотность раствора. Если мы обозначим: с - процентная концентрация; M - молярная концентрация; N - нормальная концентрация; э - эквивалентная масса, r - плотность раствора; m - мольная масса, то формулы для пересчета из процентной концентрации будут следующими: M = (c • p • 10) / m N = (c • p • 10) / э Этими же формулами можно воспользоваться, если нужно пересчитать нормальную или молярную концентрацию на процентную. Пример. Какова молярная и нормальная концентрация 12%-ного раствора серной кислоты, плотность которого р = 1,08 г/см3? Решение. Мольная масса серной кислоты равна 98. Следовательно, m(H2SO4) = 98 и э(H2SO4) = 98 : 2 = 49. Подставляя необходимые значения в формулы, получим: а) Молярная концентрация 12% раствора серной кислоты равна M = (12 1,08 • 10) / 98 = 1,32 M б) Нормальная концентрация 12% раствора серной кислоты равна N = (12 1,08 • 10) / 49 = 2,64 H. Иногда в лабораторной практике приходится пересчитывать молярную концентрацию в нормальную и наоборот. Если эквивалентная масса вещества равна мольной массе (Например, для HCl, KCl, KOH), то нормальная концентрация равна молярной концентрации. Так, 1 н. раствор соляной кислоты будет одновременно 1 M раствором. Однако для большинства соединений эквивалентная масса не равна мольной и, следовательно, нормальная концентрация растворов этих веществ не равна молярной концентрации. Для пересчета из одной концентрации в другую можно использовать формулы: M = (N • Э) / m N = (M • m) / Э Пример. Нормальная концентрация 1 М раствора серной кислоты N = (1 • 98) / 49 = 2 H. Пример. Молярная концентрация 0,5 н. Na2CO3 M = (0,5 53) / 106 = 0,25 M. Упаривание, разбавление, концентрирование, смешивание растворов. Имеется mг исходного раствора с массовой долей растворенного вещества w1 и плотностью r1. Упаривание раствора. В результате упаривания исходного раствора его масса уменьшилась на Dm г. Определить массовую долю раствора после упаривания w2 Решение. Исходя из определения массовой доли, получим выражения для w1 и w2 (w2 > w1): w1 = m1 / m (где m1 - масса растворенного вещества в исходном растворе) m1 = w1 • m w2 = m1 / (m - Dm) = (w1 • m) / (m - Dm) Пример. Упарили 60 г 5%-ного раствора сульфата меди до 50 г. Определите массовую долю соли в полученном растворе. m = 60 г; Dm = 60 - 50 = 10 г; w1 = 5% (или 0,05) w2 = (0,05 • 60) / (60 - 10) = 3 / 50 = 0,06 (или 6%-ный) Концентрирование раствора. Какую массу вещества (X г) надо дополнительно растворить в исходном растворе, чтобы приготовить раствор с массовой долей растворенного вещества w2? Решение. Исходя из определения массовой доли, составим выражение для w1 и w2: w1 = m1 / m2, (где m1 - масса вещества в исходном растворе). m1 = w1 • m w2 = (m1+x) / (m + x) = (w1 • m + x) / (m+x) Решая полученное уравнение относительно х получаем: w2 m + w2 • x = w1 • m + x w2 m - w1 • m = x - w1 • x (w2 - w1) • m = (1 - w2) • x x = ((w2 - w1) • m) / (1 - w2) Пример. Сколько граммов хлористого калия надо растворить в 90 г 8%-ного раствора этой соли, чтобы полученный раствор стал 10%-ным? m = 90 г w1 = 8% (или 0,08), w2 = 10% (или 0,1) x = ((0,1 - 0,08) • 90) / (1 - 0,1) = (0,02 • 90) / 0,9 = 2 г Смешивание растворов с разными концентрациями. Смешали m1 граммов раствора №1 c массовой долей вещества w1 и m2 граммов раствора №2 c массовой долей вещества w2. Образовался раствор (№3) с массовой долей растворенного вещества w3. Как относятся друг к другу массы исходных растворов? Решение. Пусть w1 > w2, тогда w1 > w3 > w2. Масса растворенного вещества в растворе №1 составляет w1 • m1, в растворе №2 - w2 • m2. Масса образовавшегося раствора (№3) - (m1 - m2). Сумма масс растворенного вещества в растворах №1 и №2 равна массе этого вещества в образовавшемся растворе (№3): w1 m1 + w2 • m2 = w3 • (m1 + m2) w1 m1 + w2 • m2 = w3 • m1 + w3 • m2 w1 m1 - w3 • m1 = w3 • m2 - w2 • m2 (w1- w3) • m1 = (w3- w2) • m2 m1 / m2 = (w3 - w2 ) / (w1- w3) Таким образом, массы смешиваемых растворов m1 и m2 обратно пропорциональны разностям массовых долей w1 и w2 смешиваемых растворов и массовой доли смеси w3. (Правило смешивания). Для облегчения использования правила смешивания применяют правило креста :
m1 / m2 = (w3 - w2) / (w1 - w3) Для этого по диагонали из большего значения концентрации вычитают меньшую, получают (w1 - w3), w1 > w3 и (w3 - w2), w3 > w2. Затем составляют отношение масс исходных растворов m1 / m2 и вычисляют. Пример. Определите массы исходных растворов с массовыми долями гидроксида натрия 5% и 40%, если при их смешивании образовался раствор массой 210 г с массовой долей гидроксида натрия 10%.
5 / 30 = m1 / (210 - m1) 1/6 = m1 / (210 - m1) 210 - m1 = 6m1 7m1 = 210 m1 =30 г; m2 = 210 - m1 = 210 - 30 = 180 г Разбавление раствора. Исходя из определения массовой доли, получим выражения для значений массовых долей растворенного вещества в исходном растворе №1 (w1) и полученном растворе №2 (w2): w1 = m1 / (r1 • V1) откуда V1= m1 /( w1 • r1) w2 = m2 / (r2 • V2) m2 = w2 • r2 • V2 Раствор №2 получают, разбавляя раствор №1, поэтому m1 = m2. В формулу для V1 следует подставить выражение для m2. Тогда V1= (w2 • r2 • V2) / (w1 • r1) m2 = w2 • r2 • V2 или w1
r1 • V1
= w2 • r2 • V2 m1(раствор) / m2(раствор) = w2 / w1 При одном и том же количестве растворенного вещества массы растворов и их массовые доли обратно пропорциональны друг другу. Пример. Определите массу 3%-ного раствора пероксида водорода, который можно получить разбавлением водой 50 г его 3%-ного раствора. m1(раствор) / m2(раствор) = w2 / w1 50 / x = 3 / 30 3x = 50 • 30 = 1500 x = 500 г Последнюю задачу можно также решить, используя "правило креста":
3 / 27 = 50 / x x = 450 г воды 450 г + 50 г = 500 г Список литературы Для подготовки данной работы были использованы материалы с сайта http://schoolchemistry.by.ru/ |
|
|
| 17.06.2012 |
| Большое обновление Большой Научной Библиотеки |
| 12.06.2012 |
| Конкурс в самом разгаре не пропустите Новости |
| 08.06.2012 |
| Мы проводим опрос, а также небольшой конкурс |
| 05.06.2012 |
| Сена дизайна и структуры сайта научной библиотеки |
| 04.06.2012 |
| Переезд на новый хостинг |
| 30.05.2012 |
| Работа над улучшением структуры сайта научной библиотеки |
| 27.05.2012 |
| Работа над новым дизайном сайта библиотеки |